
科目: 来源: 题型:
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目: 来源: 题型:
A.碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
B.碳酸铵分解是因为外界给予了能量
C.碳酸铵分解是吸热反应,根据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
查看答案和解析>>
科目: 来源: 题型:
A.水总是自发地由高处往低处流
B.放热反应容易自发进行,吸热反应不能自发进行
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌的毫无规律的混乱排列的几率大
查看答案和解析>>
科目: 来源: 题型:
(1)沉淀物的颜色是______________。
(2)硫酸盐还原菌是地球上最古老的微生物之一。这种微生物适宜的生长环境,除温度25—30 ℃和pH在7.2—7.5以外,还有______________________________。
(3)锈瘤中的硫化物是(写化学式)_____________________________。
(4)写出上述有关的离子方程式______________和化学方程式_________________________。
查看答案和解析>>
科目: 来源: 题型:
金属 | 电子流动方向 | 电压/V |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
C | C→Cu | +1.35 |
D | D→Cu | +0.30 |
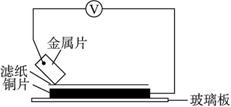
图1-22
已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请依据表中的数据判断:
(1)______________金属可以是最强的还原剂;______________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸上能看到有蓝色沉淀析出的是______________(填字母)金属。其对应的原电池的电极反应式为:
负极:_______________________________________________,
正极:_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:

图1-21
试完成下列问题:
(1)两次操作过程中指针为什么会发生偏转?______________。
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释。
(3)①操作过程中C1棒上发生的反应为____________________________。
(4)②操作过程中C2棒上发生的反应为____________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
阳极:______________;阴极:______________。总反应式:______________。
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是______________,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阳极室和阴极室,其作用是______________。
(3)为了使电解氯化钠的速度加快,下列措施可行的是( )
a.增加阴极碳钢网面积 b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离 d.提高电解时的电源电压
(4)如果对某离子交换膜电解槽采取下列措施:①电解时的电压增大到原来的2倍;②电解时电流强度增大到原来的2倍;③电解时的温度从30 ℃提高到60 ℃。则电解速率一定会达到原来的2倍的是______________,解释其原因:_____________________________________
____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)开始时三者反应速率的大小为______________。
(2)三支试管中参加反应的锌的质量为______________。
(3)反应终了,所需时间为______________。
(4)在反应过程中,乙、丙速率不同的理由是_________________________________________
_______________________________________(简要说明)。
查看答案和解析>>
科目: 来源: 题型:
A.2 mol B.3 mol C.4 mol D.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com