
科目: 来源: 题型:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2—3遍。
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50—80 ℃之间至铁屑耗尽。
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,滤出晶体,用少量冰水洗涤2—3次,再用滤纸将晶体吸干。
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是____________,加热的作用是______________________________。
(2)实验步骤②明显不合理,理由是______________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是__________________________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
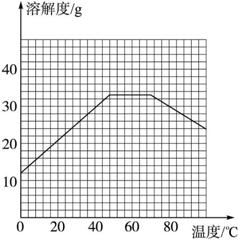
图3-8
(5)若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为_______。
查看答案和解析>>
科目: 来源: 题型:
(1)理论上FeS的溶解度为_______________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里[Fe2+]达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
Ca5(PO4)3OH(s)![]() 5Ca2++3
5Ca2++3![]() +
+
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是_________
_____________________________________________________________________。
已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:___________________________________。
根据以上原理,请你提出另外一种促进矿化的方法:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
[已知:Ksp(AgCl)=1.8×10-10 mol2·L-2 Ksp(AgBr)=5.0×10-13 mol2·L-2 Ksp(AgI)=8.3×10-17 mol2·L-2]
查看答案和解析>>
科目: 来源: 题型:
A.[Ba2+]=[![]() ]=(Ksp)1/2
]=(Ksp)1/2
B.[Ba2+]·[![]() ]>Ksp,[Ba2+]=[
]>Ksp,[Ba2+]=[![]() ]
]
C.[Ba2+]·[![]() ]=Ksp,[Ba2+]>[
]=Ksp,[Ba2+]>[![]() ]
]
D.[Ba2+]·[![]() ]≠Ksp,[Ba2+]<[
]≠Ksp,[Ba2+]<[![]() ]
]
查看答案和解析>>
科目: 来源: 题型:
①热纯碱溶液的洗涤油污能力强 ②误将钡盐〔BaCl2、Ba(NO3)2〕当作食盐混用后,常用0.5%的Na2SO4溶液解毒 ③溶洞、珊瑚的形成 ④碳酸钡不能做“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
A.②③④ B.①②③ C.③④⑤ D.①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
A.1.1×10-30 mol5·L-5 B.1.1×10-28 mol5·L-5
C.5.0×10-30 mol5·L-5 D.1.0×10-12 mol5·L-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com