
科目: 来源: 题型:
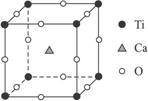
图3-7
(1)在该物质的晶体中,每个钛离子周围与它最接近的且等距离的钛离子共有__________个。
(2)该晶体中,元素氧、钛、钙的个数比是_______________。
查看答案和解析>>
科目: 来源: 题型:
A.外形不一样
B.普通玻璃的基本构成微粒无规则性地排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
查看答案和解析>>
科目: 来源: 题型:
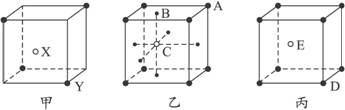
图3-6
试写出:
(1)甲晶体化学式(X为阳离子)为___________________。
(2)乙晶体中A、B、C三种微粒的个数比是______________。
(3)丙晶体中每个D周围结合E的个数是_______________个。
查看答案和解析>>
科目: 来源: 题型:
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.依据构成微粒的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体
查看答案和解析>>
科目: 来源: 题型:
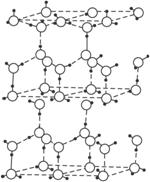
图2-13
(1)含1 mol冰中有___________mol“氢键”。
(2)水分子中可电离生成两种含有相同电子数的微粒,其电离方程式为___________。
(3)在冰的结构中,每个水分子与相邻的4个分子氢键相连接。在冰中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰中氢键的能量是__________kJ·mol-1。
(4)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系______________________,其判断依据是______________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

图2-12
试完成下列问题:
(1)写出H2O2分子的结构式。
(2)H2O2分子内有______________(填“极性键”或“非极性键”)。
(3)估计它难溶于CS2,简要说明原因。
(4)指出氧元素的化合价,简要说明原因。
查看答案和解析>>
科目: 来源: 题型:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两种元素可以形成4核(其中3个Z和1个Y)42个电子的负一价阴离子。
据此,请填空:
(1)X元素____________,Y元素____________,Z元素____________。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是____________,其中的阴离子的立体构型为____________,中心元素原子的杂化方式是____________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com