
科目: 来源: 题型:
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属元素原子的第一电离能最大
查看答案和解析>>
科目: 来源: 题型:
物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
能量kJ | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HF B.HCl C.HBr D.HI
(3)由键能数据推算:
①反应I2+H2![]() 2HI是吸热反应还是放热反应? 。
2HI是吸热反应还是放热反应? 。
②相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,热量变化最多的是__________。
(4)若无上表中的数据,你能正确回答出(3)中问题②吗?________。你的根据是_________________。
查看答案和解析>>
科目: 来源: 题型:
(1)钛元素的同位素有:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.据此可计算出钛元素的相对原子质量为48
B.钛元素的五种同位素化学性质均不相同
C.钛元素在元素周期表中位于第四周期
D.钛与26Fe同为第Ⅷ族元素
(2)TiO2是高级的白色颜料,它的制取方法如下:
第一步:使钛铁矿与硫酸反应,FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
TiOSO4+FeSO4+2H2O,此时,钛铁矿中的Fe2O3也与H2SO4发生反应,可加入铁屑使将生成的Fe3+还原成Fe2+。写出此还原过程的离子反应方程式:______________________________________________________。
第二步:水解,TiOSO4+2H2O![]() TiO2·H2O+H2SO4 ΔH>0。
TiO2·H2O+H2SO4 ΔH>0。
制TiO2的关键是第二步水解反应。为使第二步水解反应进行得更完全,可采用下列_______措施。
A.加酸 B.加碱 C.加热 D.加压
(3)最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子。则它的化学式为__________________________。

查看答案和解析>>
科目: 来源: 题型:
(1)ClO-的电子式为______。
(2)![]() 的中心原子采用的杂化方式是________,该离子的空间构型是__________。
的中心原子采用的杂化方式是________,该离子的空间构型是__________。
(3)![]() 的中心原子采用的杂化方式是________,该离子的空间构型是__________。
的中心原子采用的杂化方式是________,该离子的空间构型是__________。
(4)![]() 的中心原子采用的杂化方式是________,该离子的空间构型是__________。
的中心原子采用的杂化方式是________,该离子的空间构型是__________。
查看答案和解析>>
科目: 来源: 题型:
(1)符合上述条件的元素有___________种,原子序数分别是___________。
(2)写出相应元素原子的以下信息 (可填满,也可不填满):
序号 | 元素符号 | 基态原子核外电子排布式 | 在周期表中位置 | 最高正化合价 | 金属元素还是非金属元素 | ||
周期 | 区 | 族 | |||||
元素① |
|
|
|
|
| ||
元素② |
|
|
|
|
| ||
元素③ |
|
|
|
|
| ||
元素④ |
|
|
|
|
| ||
查看答案和解析>>
科目: 来源: 题型:
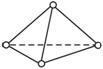
(1)分子中P—P键之间的夹角为_____________。
(2)1 mol P4分子中有___________mol P—P键。
(3)P4分子是___________ (选填“极性”或“非极性”)分子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com