
科目: 来源: 题型:
Ⅱ.实验室制备氨气,下列方法适宜选用的是______________。?
①加热分解固态氯化铵 ②向固体氢氧化钠中滴加浓氨水 ③氯化铵溶液与氢氧化钠溶液共热?④固态氯化铵与氢氧化钙混合加热?
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。?

[实验操作]?
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。?
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。?
完成下列问题:?
(1)检验氢气纯度的目的是______________。?
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是______________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是________________________________________,C瓶内气体的成分是______________。?
(3)在步骤③中,先加热铁触媒的原因是____________________________。反应管E中发生反应的化学方程式是____________________________。
查看答案和解析>>
科目: 来源: 题型:
A.15 mol、25% B.20 mol、50%?
C.20 mol、75% D.40 mol、80%?
查看答案和解析>>
科目: 来源: 题型:
(1)若a=0,b=0,则c=_______。?
(2)若a=1,c=2,则b=_______。?
(3)a、b、c取值必须满足的一般条件是_______、_______(用两个式子表示:其中一个只含a和c,另一个只含b和c)。??
查看答案和解析>>
科目: 来源: 题型:
(1)有人设计了以下反应途径,假设反应都能进行,你认为最合理的是( )?
A.C3H8![]() C+H2?
C+H2?
B.C3H8![]() C3H6+H2?
C3H6+H2?
C.C3H8+H2O![]() CO+H2?
CO+H2?
D.C3H8+O2![]() CO2+H2O,H2O
CO2+H2O,H2O![]() H2↑+O2↑?
H2↑+O2↑?
(2)按以上最合理的反应途径,理论上用1 mol丙烷最多可制得氨( )?
A.4 mol B.6.7 mol C.10 mol D.2.7 mol
(3)该合理的反应途径最显著的优点是( )?
A.简单易行 B.制得的H2纯度高?
C.制得的H2产量高 D.可同时获得大量热能?
查看答案和解析>>
科目: 来源: 题型:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
分析表中数据,完成:?
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡_______(填“向左”“向右”或“不”)移动,理由是_____________________。?
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡_______移动,判断的依据是____________________________,可能的原因是____________________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
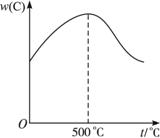
(1)正反应是_______(填“放热”或“吸热”)反应。?
(2)t<
(3)t>
查看答案和解析>>
科目: 来源: 题型:
A.达到平衡时N2、H2、NH3的含量相等?
B.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡的小?
C.达到平衡时,升高温度,加快了逆反应速率,减慢了正反应速率,所以平衡向逆反应方向移动?
D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率加快了,逆反应速率减慢了?
查看答案和解析>>
科目: 来源: 题型:
A.从合成塔出来的混合气体,其中NH3只占13%~14%,所以生产氨的工厂的效率都很低?
B.由于氨易液化,N2(g)、H2(g)是循环使用的,总体来讲氨的产率比较高?
C.合成氨反应温度控制在
D.合成氨采用的压强是2×107 Pa~5×107 Pa,因为该压强下铁触媒的活性最大?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com