
科目: 来源: 题型:
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿在沸腾炉中不能燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
查看答案和解析>>
科目: 来源: 题型:
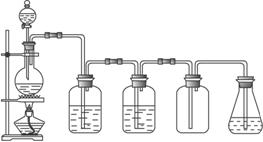
(1)在烧瓶里加热反应的试剂是下列的( )
A.硫化亚铁和稀硫酸 B.亚硫酸钠和盐酸
C.食盐固体和浓硫酸 D.二氧化锰和浓盐酸
(2)自左向右,两个洗气瓶分别装有( )
A.NaOH溶液和浓硫酸 B.水和浓硫酸
C.饱和食盐水和浓硫酸 D.水和烧碱溶液
(3)集气瓶里收集的气体是( )
A.Cl2 B.H2S C.SO2 D.HCl
查看答案和解析>>
科目: 来源: 题型:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在___________的郊区(填选项的序号)。
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人中稠密的文化、商业中心城市
(2)据推算,接触法制硫酸过程中,若反应热都未被利用,则每生产 1 t 98%的硫酸需消耗3.6×105 kJ能量。请通过计算判断,若反应:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g);ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦能量?(H2SO4的摩尔质量为
SO3(g);ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦能量?(H2SO4的摩尔质量为
查看答案和解析>>
科目: 来源: 题型:

(1)该实验的目的是:__________________________________________________。
(2)该实验的原理是(用化学方程式表示):_________________________________。
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹(K3)、橡皮管、橡皮塞以及若干玻璃管连件外,还有哪几种(写仪器名称) ___________,实验所用试剂为:______________________。
(4)实验步骤:①按图连接好仪器。②扭开活塞K1和K2,主要现象为___________。③关闭活塞K1和K2,打开止水夹K3,要使烧瓶内产生喷泉可采用的方法是___________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(1)第一阶段,氨氧化成NO,化学方程式为__________(标出电子转移情况)。这是_________(填“放热”或“吸热”)反应,气体体积__________(填“缩小”或“增大”),气体平均相对分子质量__________(填“变大”或“变小”)。若没有催化剂,氨只能在纯氧中燃烧生成N2,有关化学方程式为_____________________________________________________________________。
(2)第二阶段:NO氧化成NO2,NO2被水或稀硝酸吸收生成硝酸。若用稀硝酸吸收NO2,化学方程式为________________________________________。
(3)从吸收塔出来的尾气中尚含有少量未被吸收的__________,为消除它们对大气污染,可用烧碱溶液吸收,制得重要的化工原料NaNO2,有关化学方程式为______________________。
(4)氨催化氧化法制得的硝酸浓度一般为50%左右,如果要制更浓的硝酸,可用__________、__________作为吸水剂,然后__________(“蒸发”或“蒸馏”)稀HNO3,即可得到96%以上的浓硝酸。
查看答案和解析>>
科目: 来源: 题型:
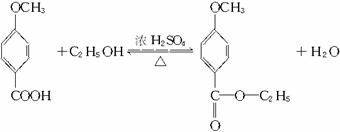
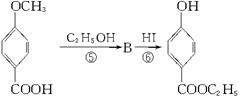
工业上用甲苯生产对羟基苯甲酸乙酯![]() ,其生产过程如下图(反应条件没有全部注明)
,其生产过程如下图(反应条件没有全部注明)

根据上图回答:
(1)有机物A的结构简式为_________。
(2)反应⑤的化学方程式(有机物写结构简式,要注明反应条件):__________________。
(3)反应②的反应类型是_________ (填编号,下同),反应④的反应类型属_________。
A.取代反应 B.加成反应 C.氧化反应 D.酯化反应
(4)反应③的化学方程式(不用写反应条件,但要配平):___________________________。
(5)在合成线路中,设计第③和⑥这两步反应的目的是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com