
科目: 来源: 题型:
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠
④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
查看答案和解析>>
科目: 来源: 题型:
13.一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1 mol SO3(g)
B.保持温度和容器内压强不变,充入1 mol SO3(g)
C.保持温度和容器内压强不变,充入1 mol O2(g)
D.保持温度和容器内压强不变,充入1 mol Ar(g)
查看答案和解析>>
科目: 来源: 题型:
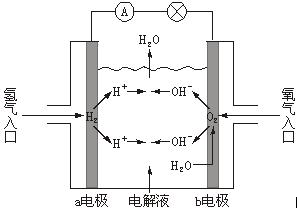
A.a电极是负极
B.b电极的电极反应为:4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目: 来源: 题型:
A.(W-B)![]() g
g
B.(W-B)![]() g
g
C.(W-B)![]() g
g
D.(W-![]() B)g
B)g
查看答案和解析>>
科目: 来源: 题型:
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合,
c(Cl-)>c(NH![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
A.溴水
B.FeCl3溶液
C.酸性KMnO4溶液
D.AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
A.18O 31P 119Sn
B.27Al 19F 12C
C.元素周期表中ⅤA族所有元素的原子
D.元素周期表中第Ⅰ周期所有元素的原子
查看答案和解析>>
科目: 来源: 题型:
A.9 g重水所含有的电子数为5NA
B.1 mol MgCl2中含有离子数为NA
C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1 mol C10H22分子中共价键总数为31NA
查看答案和解析>>
科目: 来源: 题型:
CH2=CH2+Cl2![]() CH2Cl—CH2Cl ①
CH2Cl—CH2Cl ①
CH2Cl—CH2Cl![]() CH2=CHCl+HCl ②
CH2=CHCl+HCl ②
请回答以下问题:
(1)已知反应①中二氯乙烷的产率(产率=![]() ×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t(计算结果保留1位小数)。
×100%)为98%,反应②中氯乙烯和氯化氢的产率均为95%,则2.8 t乙烯可制得氯乙烯 t,同时得到副产物氯化氢 t(计算结果保留1位小数)。
(2)为充分利用副产物氯化氢,该工厂后来将下列反应运用于生产:
2CH2=CH2+4HCl+O2![]() 2CH2Cl—CH2Cl+2H2O ③
2CH2Cl—CH2Cl+2H2O ③
由反应①、③获得二氯乙烷,再将二氯乙烷通过反应②得到氯乙烯和副产物氯化氢,副产物氯化氢供反应③使用,形成了新的工艺。
由于副反应的存在,生产中投入的乙烯全部消耗时,反应①、③中二氯乙烷的产率依次为a%、c%;二氯乙烷全部被消耗时,反应②中氯化氢的产率为b%。试计算:反应①、③中乙烯的投料比为多少时,新工艺既不需要购进氯化氢为原料,又没有副产物氯化氢剩余(假设在发生的副反应中既不生成氯化氢,也不消耗氯化氢)。
查看答案和解析>>
科目: 来源: 题型:
25.某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96 g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体
2.33 g。另一份加入含0.001 mol KMnO4的酸性溶液,MnO![]() 恰好完全被还原为Mn2+。
恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com