
科目: 来源: 题型:
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
A.碳氢化合物的通式为CnH2n+2
B.石油的主要成分是碳氢化合物
C.乙炔是含碳量最高的碳氢化合物
D.碳氢化合物中的化学键都是极性键
查看答案和解析>>
科目: 来源: 题型:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
查看答案和解析>>
科目: 来源: 题型:
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O![]() 2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
2CaO + O2↑ + 2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为 。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
① 试计算样品中CaO的质量。
② 试计算样品中CaO2·XH2O的X值。
查看答案和解析>>
科目: 来源: 题型:
已知:
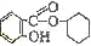
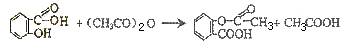
(1)写出C的结构简式 。
(2)写出反应②的化学方程式 。
(3)写出G的结构简式 。
(4)写出反应⑧的化学方程式 。
(5)写出反应类型:④ ⑦ 。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是 。
(a) 三氯化铁溶液 (b) 碳酸氢钠溶液 (c)石蕊试液
查看答案和解析>>
科目: 来源: 题型:
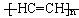
加热聚丙烯废塑料得到的产物如表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
![]()
写出反应②、③的化学方程式 、 。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
查看答案和解析>>
科目: 来源: 题型:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比
(b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量
(d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42ˉ与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42ˉ与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
查看答案和解析>>
科目: 来源: 题型:
(A)我国化学家候德榜(右下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出
(b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(B)某化学课外小组用下图装置制取溴苯。

先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式
(2)观察到A中的现象是 。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4)C中盛放CCl4的作用是 。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
查看答案和解析>>
科目: 来源: 题型:
25、在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) ![]() 2HI(g) + Q (Q>0)
2HI(g) + Q (Q>0)
反应中各物质的浓度随时间变化情况如图1:
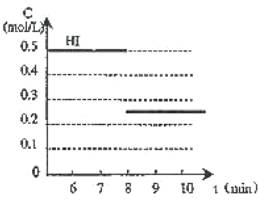
(1)该反应的化学平衡常数表达式为 。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 。
(3)反应达到平衡后,第8分钟时:
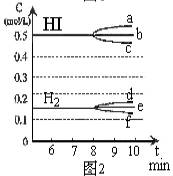
①若升高温度,化学平衡常数K (填写增大、减小或不变)
HI浓度的变化正确的是 (用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答)
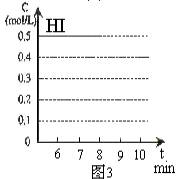
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况
查看答案和解析>>
科目: 来源: 题型:
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com