
科目: 来源: 题型:
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②将Cl2的制备和性质实验联合进行以减少实验中的空气污染
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子
⑤用溴水检验汽油中是否含有不饱和脂肪烃
A.①②③ B.①③④ C.②③⑤ D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
A.2 mol·L-1 H2SO4溶液
B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液
D.3 mol·L-1 HNO3溶液
查看答案和解析>>
科目: 来源: 题型:
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可以得到不同产物
③合成气的转化反应需在适当的温度和压强下通过催化完成
④从合成气出发生成液态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有烯烃或水
A.①②④ B.②③④ C.②④⑤ D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
查看答案和解析>>
科目: 来源: 题型:
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
查看答案和解析>>
科目: 来源: 题型:
A.O3和O2互为同位素
B.O2比O3稳定
C.等体积O3和O2含有相同质子数
D.O3与O2的相互转变是物理变化
查看答案和解析>>
科目: 来源: 题型:

⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·min-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
查看答案和解析>>
科目: 来源: 题型:
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵准确称取所制备的0.2500 g CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反化学反应为
Fe3++CuCl==Fe2++Cu2++Cl- Ce4++Fe2+==Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目: 来源: 题型:

提示:
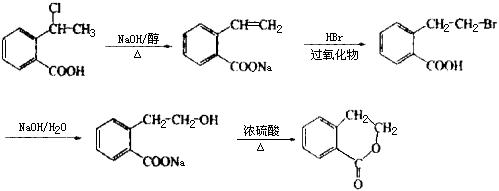
请回答下列问题:
⑴写出化合物C的结构简式_______________。
⑵化合物D有多种同分异构体,其中一类同分异构体是苯的二取代物,且水解后生成的产物之一能发生银镜反应。这类同分异构体共有_________种。
⑶在上述转化过程中,反应步骤B→C的目的是___________________________。
⑷请设计合理方案从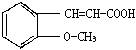 合成
合成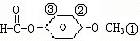 (用反应流程图表示,并注明反应条件)。
(用反应流程图表示,并注明反应条件)。
例:由乙醇合成聚乙烯的反应流程图可表示为
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com