
科目: 来源: 题型:
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为 ;
(2)A中的碳原子是否都处于同一平面? (填“是”或者“不是”);
(3)在下图中,D1 、D2互为同分异构体,E1 、E2互为同分异构体。

反应②的化学方程式为 ;C的化学名称是 ;E2的结构简式是 ;④、⑥的反应类型依次是 。
查看答案和解析>>
科目: 来源: 题型:
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是 ;
(2)B和C的分子式分别是 和 ;C分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是 ,该反应的化学方程式为 ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
查看答案和解析>>
科目: 来源: 题型:
工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7% ,O2 11%,N2 82%):
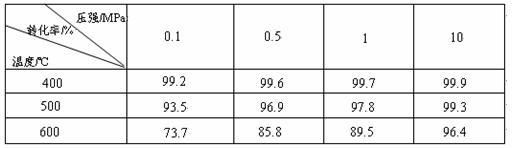
(1)已知SO2的氧化是放热反应,如何利用表中数据推断此结论?
;
(2)在大400~500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:
;
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
查看答案和解析>>
科目: 来源: 题型:
![]()
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)= mol/(L·min)。
查看答案和解析>>
科目: 来源: 题型:
锌片上发生的电极反应: ;
银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023/mol,电子电荷为1.60×10-19C)
查看答案和解析>>
科目: 来源: 题型:
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
查看答案和解析>>
科目: 来源: 题型:
A.16.7% B.20.0% C.80.0% D.83.3%
查看答案和解析>>
科目: 来源: 题型:
A.1 :7 B.7 :1 C.7 :8 D.8 :7
查看答案和解析>>
科目: 来源: 题型:
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
查看答案和解析>>
科目: 来源: 题型:
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7 :4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com