
科目: 来源: 题型:
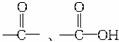
A.能发生加成、取代反应
B.能发生还原、酯化反应
C.分子内共有19个氢原子
D.分子内共平面的碳原子多于6个
查看答案和解析>>
科目: 来源: 题型:
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
A.相同条件下,N2和O3的混合气与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g ![]() 所含质子数相等
所含质子数相等
查看答案和解析>>
科目: 来源: 题型:
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
题6表
配料 | 精盐、碘酸钾、抗结剂 |
碘含量 | 35±15 mg/kg |
储存方法 | 密封、避光、防潮 |
食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目: 来源: 题型:
已知:SO2+2Fe3++2H2O=![]() +2Fe2++4H+
+2Fe2++4H+
![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
查看答案和解析>>
科目: 来源: 题型:
①将干燥的氯气在110℃~140℃与硫反应,即要得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全分解; S2Cl2+Cl2 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: ;
E中反应的化学方程式: 。
(3)C、D中的试剂分别是 、 。
(4)仪器A、B的名称分别是 、 ,F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 ,在F中可能出现的现象是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) 、 ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
查看答案和解析>>
科目: 来源: 题型:
(1)A的分子式为 。
(2)写出与A分子式相同的所有酯的结构简式:
。
已知:①ROH+HBr(氢溴酸)![]() RBr+H2O
RBr+H2O
![]()
A中含有碳氧双键,与A相关的反应如下:

(3)写出A→E、E→F的反应类型:A→E 、E→F 。
(4)写出A、C、F的结构简式:A 、C 、F 。
(5)写出B→D反应的化学方程式:
(6)在空气中长时间搅拌奶油,A可转化为相对分子质量为86的化合物G,G的一氯代物只有一种,写出G的结构简式: 。A→G的反应类型为 。
查看答案和解析>>
科目: 来源: 题型:
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)
;V、W的氢化物分子结合H+能力较强的是(写化学式) ;用一个离子方程式加以证明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是(写化学式) 。
查看答案和解析>>
科目: 来源: 题型:
A.充电时,电池的负极反应为LiC6-e-=Li++C6
B.放电时,电池的正极反应为CoO2+Li++e-=LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目: 来源: 题型:
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com