
科目: 来源: 题型:
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
___________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
___________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是__________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为![]()
![]()
![]() 和a的代数式表示)。
和a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
(1)甲一定含有的官能团的名称是____________________________________。
(2)
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)
_____________________________________________________。
(4)已知:
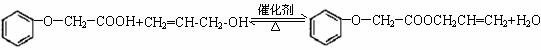
![]()
菠萝酯的合成路线如下:
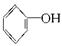
①试剂X不可选用的是(选填字母)____________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是_________________,反应Ⅱ的反应类型是___________。
③反应Ⅳ的化学方程式是 __________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);![]() mol(Q>0)
mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
科目: 来源: 题型:
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(![]() )>c(
)>c(![]() )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X,Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目: 来源: 题型:
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
查看答案和解析>>
科目: 来源: 题型:
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分子晶体中都存在范德瓦耳斯力,可能不存在共价键
查看答案和解析>>
科目: 来源: 题型:

请回答下列问题:
⑴A长期暴露在空气中会变质,其原因是 。
⑵有A到B的反应通常在低温进行。温度升高时,多硝基取代副产物会增多。下列二硝基取代物中,最可能生成的是 。(填字母)
a. b.
b. c.
c. d.
d.
⑶在E的下列同分异构体中,含有手性碳原子的分子是 。(填字母)
a. b.
b.
c. d.
d.
⑷F的结构简式 。
⑸D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是 。高聚物L由H通过肽键连接而成,L的结构简式是 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
⑴下列措施中,有利于降低大气中CO2浓度的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
⑵将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O![]() C6H12O6
C6H12O6
b.CO2 + 3H2![]() CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
⑶文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
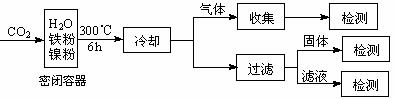
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,
即:CO2![]() HCOOH
HCOOH![]() CH4
CH4
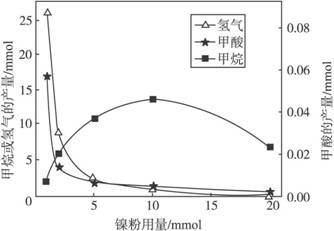
①写出产生H2的反应方程式 。
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目: 来源: 题型:
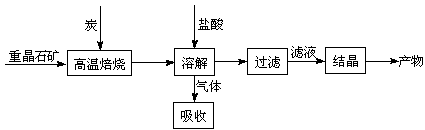
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + ![]() 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + ![]() 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com