
科目: 来源: 题型:
A.H2SeO4的氧化性弱于Cl2
B.H2SeO3的氧化性强于H2SO4
C.二氧化硒的还原性强于二氧化硫
D.析出1 mol Se,需H2SeO3、SO2、H2O各1 mol
查看答案和解析>>
科目: 来源: 题型:
A.NO2 B.NO C.N2O D.N2
查看答案和解析>>
科目: 来源: 题型:
A.氧化剂是甲醇
B.氧化产物是二氧化氯
C.还原产物与氧化产物的物质的量之比为6∶1
D.氧化剂与还原剂的物质的量之比为2∶1
查看答案和解析>>
科目: 来源: 题型:
A.3.0 mol B.1.5 mol C.1.0 mol D.0.75 mol
查看答案和解析>>
科目: 来源: 题型:
A.将足量的SO2通入棕黄色的FeCl3溶液中,最后溶液变为浅绿色
SO2+2FeCl3+2H2O====2FeCl2+H2SO4+2HCl
B.氯化亚铁溶液在空气中长期放置,会因氧化而产生红褐色浑浊现象
4FeCl2+O2+10H2O====4Fe(OH)3↓+8HCl
C.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯
3KClO3+6HCl(浓)====3KCl+2ClO2↑+2Cl2↑+3H2O
D.赤铜矿(Cu2O)和辉铜矿(Cu2S)混合加热可得铜
4Cu2O+Cu2S====10Cu+CuSO4
查看答案和解析>>
科目: 来源: 题型:
A.2.8 mol B.2.6 mol C.2.4 mol D.0.8 mol
查看答案和解析>>
科目: 来源: 题型:
2NO2+Na2CO3====NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3====2NaNO2+CO2 ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2,吸收液质量将增加________g。
(2)配制1000 g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000 g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况)CO2时,吸收液质量就增加44 g。
①计算吸收液中NaNO2和NaNO3的物质的量之比。
②1000 g质量分数为21.2%的纯碱在20 ℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0 ℃,最多可析出NaNO2多少克?(0 ℃时,NaNO2的溶解度为71.2 g/100 g水)。
查看答案和解析>>
科目: 来源: 题型:
(1)滴入酚酞,溶液显红色,x的值应在___________范围内,y=___________(用x的代数式表示,下同)。
(2)容器中有不溶气体,此气体在空气中变为红棕色,x的值应在_________________范围内,y=_________。
(3)容器中有不溶气体,此气体在空气中不变色,溶液的物质的量浓度约为_________。
查看答案和解析>>
科目: 来源: 题型:
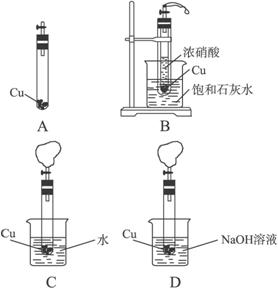
先将适量块状CaCO3和过量铜片放入底部开一小孔的试管中,塞上塞子(连有带活塞的导气管),如图A所示,再将试管放入盛有适量盐酸的烧杯中,打开活塞,发生反应:CaCO3+2HCl====CaCl2+H2O+CO2↑,用产生的CO2排尽试管内的空气。
(1)待CaCO3反应完全后,关闭活塞,在导气管上套一排尽空气的气球,然后将试管放入盛有浓硝酸的大试管中,如图B所示。再打开活塞,观察到的现象是_________________。上述现象说明____________________________________________________。有关反应的离子方程式为_____________________________________________________________________。
(2)上述反应进行一段时间后,关闭活塞,迅速将带小孔的试管取出,放入盛有适量水的烧杯中,如图C所示,再打开活塞,观察到的现象是_______________________________。
(3)关闭活塞,迅速将试管取出,放入盛有足量NaOH溶液的烧杯中,如图D所示。打开活塞,NO、NO2与NaOH溶液发生反应:2NaOH+NO+NO2====2NaNO2+H2O,气球逐渐变小,试管内液面上升。NO不能单独与NaOH溶液反应,若要将氮的氧化物完全吸收,应该如何操作?___________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com