
科目: 来源: 题型:
A.1∶1 B.1∶2 C.3∶2 D.2∶3
查看答案和解析>>
科目: 来源: 题型:
A.a=b B.a=2b C.2a=b D.a=5b
查看答案和解析>>
科目: 来源: 题型:
A.当A、B都是金属时,A的还原性一定比B强
B.当A、B都是非金属时,A的非金属性一定比B强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是非金属,也可能是金属
查看答案和解析>>
科目: 来源: 题型:
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均相同
D.金属元素的单质在常温下均为金属晶体
查看答案和解析>>
科目: 来源: 题型:
A.导电、导热性好 B.不易生锈
C.密度小 D.强度高
查看答案和解析>>
科目: 来源: 题型:
(1)请设计配制方案。
(2)如果要求尽可能多地使用现有食盐溶液,应怎样设计实验方案。
查看答案和解析>>
科目: 来源: 题型:
(1)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能的杂质是__________。它是由________________而产生的。如果滤液中该杂质的含量不是很低,其检测方法是________________________________。
(2)设Na2SO3跟硫粉完全反应,将滤液蒸发浓缩后,冷却至70 ℃,溶液的体积约为30 mL,该溶液是否达到饱和?试通过计算说明。(70 ℃时,Na2S2O3饱和溶液的密度为1.17 g·cm-3)
(3)若要计算在100 ℃下将溶液蒸发至体积为30.0 mL,再冷却至10 ℃所能得到的Na2S2O3·5H2O的质量,你认为__________(填写1个选项字母)。
A.前面提供的数据已经足够
B.还需要提供100 ℃时溶液的密度(1.14 g·cm-3)
C.还需提供结晶后剩余溶液体积(10.0 mL)
(4)根据第(3)小题的选择(如选A项则直接计算,如选B项或C项则可选用其数据计算),计算从10 ℃ 30.0 mL溶液中结晶析出的Na2S2O3·5H2O质量。
查看答案和解析>>
科目: 来源: 题型:
I-+![]() +H+
+H+![]() I2+H2O
I2+H2O
Cu2++I-![]() CuI↓+I2
CuI↓+I2
I2+![]()
![]() I-+
I-+![]() (均未配平)
(均未配平)
(1)原Cu(IO3)2饱和溶液中溶质的物质的量浓度是多少?
(2)若Cu(IO3)2饱和溶液的密度为1.0 g·cm-3,室温时,Cu(IO3)2的溶解度是多少?
查看答案和解析>>
科目: 来源: 题型:
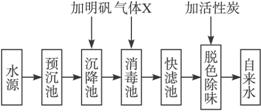
(1)气体X的化学式为___________。
(2)生产中,通入消毒池的气体X一般是定量的,水流在进入消毒池前要进行pH监测调控,这是因为若pH太低,易腐蚀设备;若pH过高,会造成自来水质量下降,不符合卫生标准,这是由于____________________________________________。
(3)该水厂在技术改造中,采用高效混凝剂——高铁酸钠(Na2FeO4),其反应情况为:
![]() +
+![]() +H2O
+H2O![]()
![]() +Fe(OH)3
+Fe(OH)3
使用Na2FeO4的优点是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com