
科目: 来源: 题型:
A.NaHCO3的水解:![]() +H2O
+H2O![]() H3O++
H3O++![]()
B.金属铝溶于NaOH溶液:Al+2OH-====![]() +H2↑
+H2↑
C.钢铁吸氧腐蚀的正极反应式:4OH――4e-====O2+2H2O
D.1 L 0.5 mol·L-1稀硫酸与1 L 1 mol·L-1氢氧化钠溶液反应放出57.3 kJ的热:
H2SO4(aq)+2NaOH(aq)====Na2SO4(aq)+2H2O(l);ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
A.H2的还原性一定比CO强 B.CO还原性一定比H2强
C.反应条件对物质的还原性存在影响 D.以上反应不是氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
A.ClO-、Na+、Cl-、S2- B.![]() 、K+、Na+、Fe2+
、K+、Na+、Fe2+
C.Cu2+、 K+、![]() 、
、![]() D.
D.![]() 、Na+、
、Na+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目: 来源: 题型:
A.分解反应都属于氧化还原反应
B.化合反应都属于非氧化还原反应
C.复分解反应肯定都属于非氧化还原反应
D.有单质参与反应并有新单质生成的反应肯定都是氧化还原型的置换反应
查看答案和解析>>
科目: 来源: 题型:
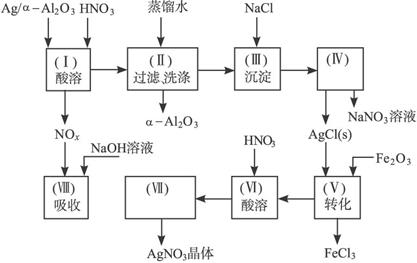
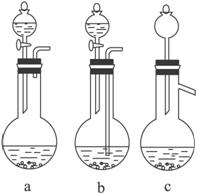
图15-18
阅读上述实验流程,完成下列填空:
(1)Ag/αAl2O3加酸溶解应该选用装置____________________________(选填a、b、c)。
(2)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式为_________________________________。
(3)实验操作(Ⅳ)所需玻璃仪器为_________________(填写三种)。
(4)实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为:________。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
(5)已知:NO+NO2+2NaOH====2NaNO2+H2O;
2NO2+2NaOH====NaNO3+NaNO2+H2O。
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为________________。
a.x≤1.5 b.x=1.2 c.x≥1.5
(6)已知Ag/αAl2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为_____和__________。
查看答案和解析>>
科目: 来源: 题型:
(1)混合气体进入反应管后,量气管内增加的水的体积等于的_____________________体积(填写气体的化学式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_____________(选填:“偏高”“偏低”或“不受影响”)。
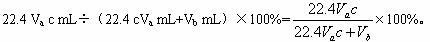
图15-17
(3)反应管内的碘的淀粉溶液也可以用_______________________代替(填写物质名称)。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1。N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb?表示SO2的体积百分含量为_______________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为_____________(选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
查看答案和解析>>
科目: 来源: 题型:

图15-16
请完成下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
________________________________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理?___________。请简要说明两点理由:①_________;②_________。
查看答案和解析>>
科目: 来源: 题型:
(1)下列实验操作或对实验事实的叙述正确的是_____________(填序号)。
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.100 0 mol·L-1 KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
(2)为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用图15-15所示的实验装置,测定乙醇与钠反应(ΔH<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试完成下列问题:

图15-15
①指出实验装置中的错误_____________。
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将_____________(填“偏大”“偏小”或“不变”)。
③请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)____________。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ.第一小组对市场上的碘盐进行了研究。在碘盐里,碘以KIO3形式存在。请完成下列问题:
(1)正确食用碘盐才能起到补碘的作用,该小组对油炸食品是否适宜放碘进行了课题研究。
请你协助拟定课题名称:______________________________。
其研究成果的最终形式是:______________________________。
(2)怎样检验碘盐中含有碘?(可供选择的试剂有:稀硝酸、稀盐酸、KCl、KI淀粉溶液、石蕊试液)用离子反应方程式表示______________________________。
Ⅱ.第二小组利用废铜制取CuSO4:
(1)甲学生进行了下列实验:取含6.4 g铜的废铜和10 mL 18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。你认为他的判断是否正确___________(填“是”或“否”),其理由是:_____________________________________________________。
(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是:
2Cu+O2![]() 2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是:
2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是:
_____________________________________________________________________。
(3)某地有丰富的电力源。为了具备乙同学的优点,你能不能根据该地的资源优势也设计一个用铜和硫酸制取CuSO4的方案?(其他材料任选)_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com