
科目: 来源: 题型:

(1)同主族内不同元素的E值变化的特点是:__________________________________。各主族中E值的这种变化特点体现了元素性质的____________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列关系式中正确的是__________(填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:_________________<
E<______________________。
(4)10号元素E值较大的原因是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)原子最外层电子数是最内层电子数的2倍的是____________;
(2)最高价氧化物对应的水化物的酸性最强的元素是__________,跟它处在同一周期的还有一种非金属元素是__________;
(3)原子半径最大的是__________,它的相邻元素是__________;
(4)剩余的两种元素,它们的离子电子层结构相同,且带电荷量也相同,但电性相反的两种元素是__________和__________。
查看答案和解析>>
科目: 来源: 题型:
A. ![]() 中氮氮原子之间以共价键相结合
中氮氮原子之间以共价键相结合
B.![]() 中As与F之间的化学键为离子键
中As与F之间的化学键为离子键
C.1 mol ![]() 共有34×6.02×1023个核外电子
共有34×6.02×1023个核外电子
D.在化合物N5AsF6中,氟元素呈-1价
查看答案和解析>>
科目: 来源: 题型:
①F2和Br2的沸点 ②纯水在25 ℃和80 ℃时的pH ③同温下分别在100 g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量④25 ℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 ⑤在NH3+NO![]() N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数( )
N2+H2O反应中,被氧化和被还原的N原子数 ⑥耐火材料MgO和CaO的熔点 ⑦H-和H+半径 ⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数( )
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.②⑥⑦
查看答案和解析>>
科目: 来源: 题型:
 (图中●代表磷原子,○代表氧原子)。P4O10极易与水化合,它也可与乙醇、氨等某些具有强极性键的分子结合,反应过程与同水反应类似。每摩尔P4O10与足量的氨反应,最多可消耗氨的物质的量为( )
(图中●代表磷原子,○代表氧原子)。P4O10极易与水化合,它也可与乙醇、氨等某些具有强极性键的分子结合,反应过程与同水反应类似。每摩尔P4O10与足量的氨反应,最多可消耗氨的物质的量为( )
A.6 mol B.8 mol C.10 mol D.12 mol
查看答案和解析>>
科目: 来源: 题型:
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N—2N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
查看答案和解析>>
科目: 来源: 题型:
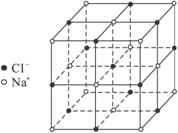
A.乙烯和丙烯的混合物1.4 g中含有0.1Na个碳原子
B.6.8 g熔融的KHSO4中含有0.1Na个阳离子
C.23.4 g NaCl晶体中含有0.4NA个上图所示的结构单元
D.电解精炼铜时转移0.1NA个电子时阳极溶解3.2 g铜
查看答案和解析>>
科目: 来源: 题型:
A.金属Na、Mg、Al的硬度依次降低 B.HF、HCl、HBr、HI的沸点依次降低
C.干冰、钠、冰的熔点依次降低 D.O、F、H的原子半径依次减小
查看答案和解析>>
科目: 来源: 题型:
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子上连有4个氮原子、每个氮原子上连有3个碳原子
C.该晶体中碳原子和氢原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
查看答案和解析>>
科目: 来源: 题型:
A.MgS B.KCl C.MgO D.CaO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com