
科目: 来源: 题型:
①Na2SiO3+CO2+2H2O====H4SiO4↓+Na2CO3 ②SiO2+2C![]() Si+2CO↑
Si+2CO↑
③Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
④CH4比SiH4稳定
A.①④ B.②③ C.③④ D.①②③④
查看答案和解析>>
科目: 来源: 题型:
A.72 g的C60中所含分子数是0.1NA(NA表示阿伏加德罗常数的值)
B.某物质只含有一种元素,则该物质一定是纯净物
C.大气污染物中,能与人体血红蛋白结合而引起中毒的气体只有CO
D.金刚石、石墨、C60都是碳的同素异形体,性质完全相同
查看答案和解析>>
科目: 来源: 题型:
请计算(计算结果保留三位有效数字):
(1)若发烟硫酸用H2SO4·xSO3表示,则x的值是_______;
(2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448 m3(已折算成标准状况)“出口气体”所需要用水的质量;
(3)若只用98%的浓H2SO4来完全吸收SO3生产发烟硫酸,计算出448 m3(已折算成标准状况)“出口气体”所需要用98%的浓H2SO4的质量。
查看答案和解析>>
科目: 来源: 题型:
①2X+O2====2M ②2Y+O2====2Q ③2Z+O2====2R
上述方程式中除氧气外的其他物质均为氧化物,且通常状况下X、Y、Z都是气体,请根据要求回答问题:
(1)如果反应①在常温常压下即可顺利进行,则M的化学式是________________。
(2)如果反应②是一个燃烧反应,则Q的电子式是________,其分子为________(填“极性分子”或“非极性分子”)。
(3)如果反应③需在催化剂存在并加热条件下进行,则Z的化学式是____________,其固体的晶体类型为________________。
Ⅱ.(4)将6.2 g Na2O在干燥而充足的氧气中加热,充分反应;冷却后称量,固体质量为7.8 g,则该反应(反应④)的化学方程式为______________________________________。
(5)取43.2 g FeO在空气中充分加热,冷却后称量发现质量增加3.2 g,则该反应(反应⑤)的化学方程式为_______________________________________________________________。
Ⅲ.(6)反应①—⑤是氧化还原反应,但其中一个的化合价升降与另外四个有明显不同,请你找出这个反应:________________(填序号),你做此选择的理由是_________________。
查看答案和解析>>
科目: 来源: 题型:
(1)纯硫酸在液态时,自身电离的电离反应是_______________________,它在25 ℃ 时的离子积常数比1×10-14_____________(填“大”“小”或“相等”)。
(2)在纯硫酸与纯硝酸的液态混合物中,存在的阴离子主要是___________;这是因为混合液中不仅存在两种电离平衡(即硫酸与硝酸各自的电离反应),而且还因硫酸的酸性强于硝酸,又在无水条件下,混合酸中必发生(写离子方程式)________________________ 反应而造成,故硫酸与硝酸的无水混合酸中存在的化学平衡为___________________________。
(3)由于硫酸(或浓硫酸)的强烈吸水性,所以,在硫酸与硝酸的混合酸中还存在一种较为简单的含氮的阳离子,它是____________。
查看答案和解析>>
科目: 来源: 题型:
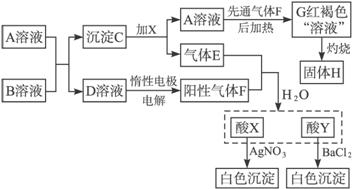
(1)请写出下列物质的化学式:C___________,H___________。
(2)E与F等体积混合溶于水生成X+Y的离子方程式为________________________,电解D溶液的离子方程式为_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
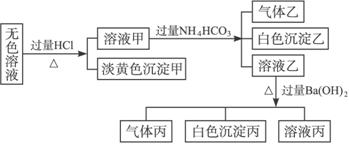
(1)沉淀甲的化学式为_________;
(2)由溶液甲生成沉淀乙的离子方程式为________________________________________;
(3)沉淀丙中一定含有_________,可能含有_________;
(4)综合上述信息,该溶液中肯定存在的离子有__________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)在用托盘天平称样品时,应先在天平两盘中各放一张__________。
(2)A的化学式为_________,A必须过量的原因是_______________________________。
(3)确定A是否过量的方法是①静置悬浊液Ⅰ,然后在上层澄清液中继续滴入几滴_____
_________溶液,若_________,则证明A已过量;②在滤液a中滴加_________溶液,若无白色沉淀生成,则证明A不足,则还继续在滤液a中加入A并过滤。
(4)白色沉淀b含有____________________________。
(5)无色溶液B通常是__________________________。
(6)通过以上测定可得到样品中杂质的质量分数的计算关系为______________________ 。
查看答案和解析>>
科目: 来源: 题型:
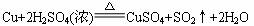
(1)根据什么现象可以判断铜跟浓硫酸反应有SO2生成________________________。
根据什么现象可以判断铜跟浓硫酸反应有硫酸铜生成_______________________。
写出甲装置中发生的主要反应的化学方程式:_________________________________。
(2)你在实验室中进行这个实验时,除了(1)小题中提到的实验现象外,还可以观察到许多其他的实验现象,请写出两种____________________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com