
科目: 来源: 题型:
A.5,5-二甲基己烷 B.2-乙基己烷
C.2,3-二甲基己烷 D.4-乙基己烷
查看答案和解析>>
科目: 来源: 题型:
A.CO B.SO2
C.甲醛、甲苯等有机物蒸气 D.臭氧
查看答案和解析>>
科目: 来源: 题型:
组别 | 镁铝合金质量/mg | HCl溶液体积/mL | 氢气的体积/mL |
甲 | 255 | 30 | 280 |
乙 | 385 | 30 | 336 |
丙 | 459 | 30 | 336 |
试完成下列问题:
(1)①甲组实验中,盐酸___________(填“过量”“适量”或“不足量”),理由是______
__________________________________________________________;
②乙组实验中,盐酸______________(填“过量”“适量”或“不足量”),理由是________
____________________;
③要计算出盐酸的物质的量浓度,题中可作计算依据的数据是________________,求得的盐酸物质的量浓度是___________;
(2)求合金中镁、铝的物质的量之比,题中可作计算依据的数据是__________,求得镁、铝的物质的量之比是__________;
(3)在丙组实验之后向容器中加入1 mol·L-1的氢氧化钠溶液,使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体。求滤液中各溶质的物质的量和所加入的氢氧化钠溶液的体积(写计算过程)。
查看答案和解析>>
科目: 来源: 题型:
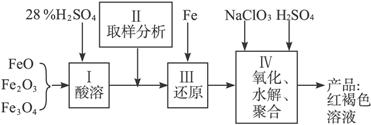
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有_______;
A.容量瓶 B.烧杯 C.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_________;
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4====3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4====3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是______________________,弊是______________________;
聚合硫酸铁溶液中![]() 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(4)测定时所需的试剂为_________;
A.NaOH B.FeSO4 C.BaCl2 D.NaClO3
(5)需要测定________和_________的质量(填写化合物的化学式);
(6)选出测定过程中所需的基本操作__________(按操作先后顺序列出)。
A.萃取、分液 B.过滤、洗涤 C.蒸发、结晶
D.冷却、称量 E.烘干或灼烧
查看答案和解析>>
科目: 来源: 题型:

(1)写出滤液A中一种溶质与过量NaOH溶液反应而进入滤液B中的离子方程式:_____
____________________。
(2)在实验①中除去了铝土矿中的__________;在实验②中,除去了铝土矿中的__________;在实验③应加入的是__________,所发生反应的离子方程式为_______________________。
(3)若实验①中不过滤,对后面的操作将产生什么样的影响:________________________。
(4)Al2O3的熔点是2045 ℃,直接受热熔融后通电进行电解冶炼铝,消耗电能太多。工业上采取的措施是熔融冰晶石(Na3AlF6),再加入Al2O3,Al2O3熔融在冰晶石里,然后通电进行电解。试评价这样的措施的意义是什么。
查看答案和解析>>
科目: 来源: 题型:
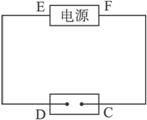
(1)A中发生反应的化学方程式为______________________。
(2)在B中观察到的现象是_____________、_____________、_____________。
(3)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168 L,若电解过程中无其他副反应发生,经测定,电解后A中溶液体积恰为1000 mL,则A溶液的pH为________。
查看答案和解析>>
科目: 来源: 题型:
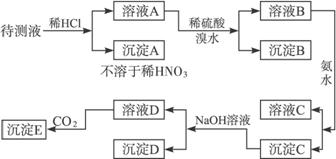
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+,并写出理由。
(2)写出沉淀D的分子式:___________________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
(1)在其水溶液中投入少量金属钠,现象是_______________________________,反应方程式为_____________________________。
(2)在其水溶液中加入过量铁粉,现象是_________________________________,反应方程式为_____________________。将变化后的溶液分装两个试管,一个试管中加入氯水,现象是_______________________,反应方程式为__________________________________;另一试管中加入NaOH溶液,现象是______________________________________,反应方程式为__________________________________。
(3)在其水溶液中加入足量的碘化钾淀粉溶液,溶液的颜色呈________色,其反应方程式为____________________________________________。
(4)如配制0.1 mol·L-1的FeCl3溶液500 mL,需FeCl3·6H2O________g。
查看答案和解析>>
科目: 来源: 题型:
(2)某学生用体积为0.1×10×25 cm3,质量分数≥99.5%的铝片和酸反应制取氢气,实验现象见下表:
| 1 min | 2 min | 5 min | 15 min | 20 min |
3 mol·L-1 HCl | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
1.5 mol·L-1 H2SO4 | 均无明显现象(只有少量气泡) | ||||
①写出铝与酸反应的离子方程式_________________________________;
②反应1—15 min内,铝与盐酸的反应逐渐加快,其原因是________________________;
③根据以上现象,可做出如下猜想:____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com