
科目: 来源: 题型:
①2MoS2+7O2![]() 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O====(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl====H2MoO4↓+2NH4Cl;
④H2MoO4![]() MoO3+H2O;
MoO3+H2O;
⑤用还原剂MoO3还原成金属钼。
则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排空
B.MoO3不溶于氢氧化钠溶液
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
科目: 来源: 题型:
A.汽车使用乙醇汽油能减少有害气体排放
B.工业上常用裂化的方法提高汽油的质量和产量
C.乙醇汽油是多种烃的混合物
D.用玉米、高粱发酵可以制得乙醇
查看答案和解析>>
科目: 来源: 题型:
(1)计算反应中消耗硝酸的物质的量。
(2)通过计算确定气体中各成分的体积。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
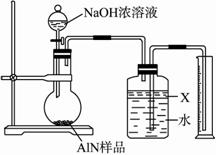
图Ⅰ?
(1)实验有关操作为:a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体;b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液;c.检验装置的气密性;d.读取收集到水的体积。正确的操作顺序为_________________。?
(2)本实验中检查装置气密性的方法是_________________________。?
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷 B.酒精
C.植物油 D.CCl4?
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为?a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为_______(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是_________________________________。
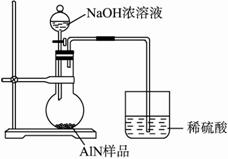
图Ⅱ?
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?_____________(填“可行”“不可行”)。理由是________________。
查看答案和解析>>
科目: 来源: 题型:
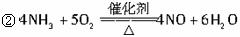
(1)物质X的化学式可能是__________,Z的化学式是__________,F的化学式是__________。
(2)写出下列化学方程式:?
反应①___________________________;?
反应②___________________________。?
(3)写出反应③的离子方程式__________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出元素符号:B________,D_________。?
(2)写出A元素的最高价氧化物的结构式_________。
(3)C的固态氧化物属于___________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:

(1)容器中气体出现红棕色的原因(用化学方程式表示)是__________________________。
(2)前2 s内,乙容器中以N2O4的浓度变化表示的反应速率为____________。
(3)达到平衡时,甲容器中反应所需的时间__________60 s(填“大于”“小于”或“等于”,以下同);两容器中都达到平衡时,N2O4的浓度甲______乙;反应过程中吸收的能量甲______乙。?
(4)两容器都达到平衡后,若要使甲、乙中N2O4浓度相等,不能采取的措施是_________。
A.保持温度不变,适当压缩甲容器体积?
B.保持容器体积不变,使甲容器升温?
C.保持容器体积和温度不变,向甲容器中加入适量N2O4
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com