
科目: 来源: 题型:
Ⅱ.RCOOR1+R2OH![]() RCOOR2+R1OH(R、R1、R2表示烃基)
RCOOR2+R1OH(R、R1、R2表示烃基)
这种材料可存在下列合成路线:
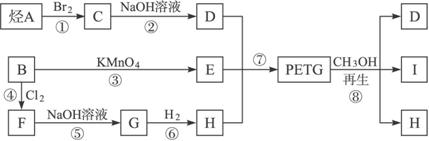
试回答下列问题:
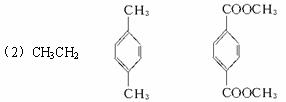
(1)合成PETG的单体有_____________种。
(2)写出A、B、I的结构简式:
A.________________,B. ________________,I. ________________。
(3)G属于酚类的同分异构体有多种,其中酚羟基互为间位的同分异构体共有________种。
(4)反应⑦中参加反应的D、E、H的物质的量之比为________________。
查看答案和解析>>
科目: 来源: 题型:
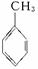
(1)写出A的结构简式_______________________________________________________
反应①的反应类型________________________________________________________
(2)写出反应②的化学方程式________________________________________________
(3)BPO分子结构对称,且分子中含有过氧键(—O—O—),也不能发生银镜反应,试写出BPO的结构简式__________。
查看答案和解析>>
科目: 来源: 题型:
如图,剪取约8 cm的镁条及大小相近的铝片,用砂纸去膜,使镁条与铝片分别与量程为500 μA的教学演示电表的“-”“+”端相连接,迅速将两电极插入盛有1 mol·L-1 NaOH溶液的烧杯中。
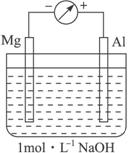
开始,电表指针向右偏移约500 μA,铝片表面有许多气泡,很快电流逐渐减小至0;随后,指针向左偏移,且电流逐渐增大至约400 μA,此时,铝片表面气泡有所减少,但镁条表面只有极少量的气泡产生。
根据以上实验现象,回答下列问题:
(1)开始阶段,原电池的正极是__________(填“Mg”或“Al”)片;铝片表面产生的气泡是__________;负极发生的电极反应是________________________________________。
(2)随后阶段,铝片发生的电极反应式是__________;镁条表面只有极少量的气泡产生,其原因是:2H2O+2e-====H2↑+2OH-(极少),试判断此电极发生的主要反应是__________;铝片表面气泡有所减少,但未消失,产生这一现象的可能原因是___________________________。
查看答案和解析>>
科目: 来源: 题型:
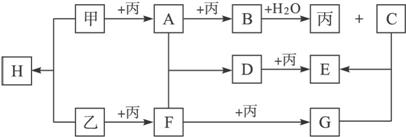
(1)写出下列物质的化学式:丙.___________,H. ___________。
(2)写出下列变化的离子方程式
B+H2O![]() 丙+C:__________________________________________________。
丙+C:__________________________________________________。
(3)乙+丙![]() F是工业上得到F的反应之一,请写出工业上得到F的另一化学反应方程式:______
F是工业上得到F的反应之一,请写出工业上得到F的另一化学反应方程式:______
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)B和E的最高价氧化物对应的水化物中酸性较强的是_______________(填化学式),写出可以验证该结论的一个离子反应方程式_______________________。
(2)王水可溶解Au、Pt等金属,其原因是王水中不仅含有HNO3,还有反应生成的Cl2和NOCl。假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式__________。
(3)B、C、D、E、F与A形成的化合物沸点最高的元素是_____________(填元素符号),原因是_____________;BD2形成的晶体中,每个分子周围紧邻的分子数是_____________个。
查看答案和解析>>
科目: 来源: 题型:

实验步骤:
(1)把30% NaOH溶液和废铁屑混合、煮沸、冷却,用清水洗净废铁屑。将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
试回答下列问题:
(1)F中的NaOH溶液的主要作用是____________________________________________。
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞______________,并同时打开活塞______________。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用____________________________。
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液,再自然冷却结晶;②不蒸发溶液,直接自然冷却结晶。你认为较好的方法是______________。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
_______________________________________、______________________________________。
查看答案和解析>>
科目: 来源: 题型:
(a)用pH试纸测量:甲瓶中消毒液pH=12,乙瓶中消毒液pH=2,且都能很快使pH试纸褪色。
(b)取少量乙瓶中的溶液,向其中加入MnO2粉末,产生大量氧气,并闻到一股醋酸气味。
(c)取少量甲瓶中的溶液,向其中加入硝酸酸化的AgNO3溶液;取少量乙瓶中的溶液,向其中加入盐酸酸化的BaCl2溶液,均有白色沉淀产生。
根据以上实验现象,回答下列问题:
(1)甲瓶中的消毒剂一定含有的阴离子是OH-和_________、_________,乙瓶中的消毒剂一定含有H+、OH-(少量)、![]() (少量)、CH3COO-、_________离子和H2O、CH3COOH、________________分子。
(少量)、CH3COO-、_________离子和H2O、CH3COOH、________________分子。
(2)将甲瓶和乙瓶溶液混合时还产生了氧气,试写出该反应的离子方程式:___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.C2H6和C3H8 B.C2H4和C2H6 C.C3H4和C3H6 D.C3H6和C4H8
查看答案和解析>>
科目: 来源: 题型:
达到平衡时,C的浓度为1.2 mol·L-1,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2 mol·L-1的是( )
A.1 mol A+0.5 mol B+1.5 mol C+0.1 mol D
B.3 mol C+0.7 mol D
C.2 mol A+1 mol B+1 mol D
D.0.5 mol A+0.25 mol B+2.25 mol C
查看答案和解析>>
科目: 来源: 题型:
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com