
科目: 来源: 题型:
氨水 分子式:NH3 相对分子质量:17 密度:088 g·cm-3 NH3的质量分数:25% |
(1)标准状况下1体积水吸收多少体积的氨气可制得上述氯水?该氨水物质的量浓度为多少?(水的密度:100 g·cm-3)
(2)经测定某硫酸厂每天排放含02%的二氧化硫(体积分数)的废气1×104 m3(标准状况),为了提高综合经济效益,用上述氨水吸收废气中的SO2来获得硫酸铵,则每天消耗该氨水约多少吨?
查看答案和解析>>
科目: 来源: 题型:
![]() (R代表烃基,下同)
(R代表烃基,下同)
R—C≡C—(CH2)n—CHCH2+H2![]() R—CHCH—(CH2)n—CHCH2
R—CHCH—(CH2)n—CHCH2
1,4-丁二醇是生产工程塑料PBT(聚对苯二甲酸丁二酯)的重要原料,它可以通过下图两种不同的合成路线制备,请写出相应物质的结构简式:

请写出:
(1)A和E的结构简式:_______________、_______________。
(2)写出生成CH2BrCH=CHCH2Br的化学反应方程式:______________________________
写出生成F(PBT)的化学反应方程式:_________________________________________。
(3)某学生研究发现由乙炔可制得乙二醇,请你设计出合理的反应流程图。
提示:①合成过程中无机试剂任选
②反应流程图表示方法示例如下:
a![]() b
b![]() c……
c……![]() 乙醇
乙醇
______________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:

(1)苯氯乙酮分子中,在同一平面的碳原子最多有___________个。
(2)苯氯乙酮不可能具有的化学性质是___________(填序号)。
A加成反应 B取代反应 C消去反应 D银镜反应
(3)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子中有苯环但不含甲基的化合物有多种,它们的结构简式:

还有___________,___________,___________(根据本题意要求,必须写全同分异构体,但不一定填满)。
查看答案和解析>>
科目: 来源: 题型:

(1)若A通常状态下为固体单质,则A、B、D分别为(写化学式)A:__________B:__________D:__________。
写出EC转化的化学方程式:__________________________________________________。
(2)若A通常状态下为气态单质,则A、B、D分别为(写化学式)A:__________B:__________D:__________。
写出EC转化的离子方程式:__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)A2B和A2D的沸点较高者为__________(填化学式),其原因是____________________。
(2)由A、B、C、D四种元素形成的两种化合物相互间反应的离子方程式为______________________________。
(3)写出由B、C两元素所形成的原子个数比为1∶1的化合物的电子式__________,其晶体中存在的化学键有____________________(填化学键名称)。
(4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后,__________极(填电极名称)附近出现红色,另一极的电极反应式为____________________,可用__________检验该极所得产物。
查看答案和解析>>
科目: 来源: 题型:

如上图所示29815 K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
(1)写出合成氨反应的热化学方程式______________________________________________;
(2)在图中曲线_____________(填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理____________________________;
(3)目前合成氨工业广泛采用的反应条件500 ℃,20—50 MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是_____________;
A降低反应温度,让反应向着有利氨气生成的方向进行
B升高反应温度,让更多的分子变成活化分子
C寻求能在更低的温度下有很强催化活性的新型催化剂
D寻求新型耐高压材料,将压强增大一倍
(4)在一定条件下,将3 mol N2和3 mol H2充入一个容积固定的密闭容器中发生反应。当反应达到平衡时NH3为n mol。在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中正确的是______________(填编号)。
编号 | 起始状态/mol | ||
N2 | H2 | NH3 | |
① | 2 | 0 | 2 |
② | 25 | 15 | 1 |
③ | 8/3 | 2 | 2/3 |
查看答案和解析>>
科目: 来源: 题型:

回答下列问题:
(1)若产生的气体由左向右流向,各装置导管的连接顺序是:G接E、F接___________、___________接___________、___________接___________。
(2)装置Ⅱ的作用是___________;装置Ⅲ的作用是___________。
(3)装置Ⅳ中的化学方程式______________________;装置Ⅴ中的化学方程式______________________。
(4)实验前称得Ⅰ、Ⅱ两装置的质量分别为m1 g和n1 g,实验完毕,称得Ⅰ、Ⅱ两装置的质量分别变为m2 g和n2 g,则乙炔分子中碳原子和氢原子的原子个数比为___________(列出算式)。经多次实验发现测得的结果与理论值存在一定偏差,你认为原因可能为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
①试液![]() 产生气泡
产生气泡![]() 白色沉淀 结论:试液中有
白色沉淀 结论:试液中有![]()
②试液![]() 颜色无变化
颜色无变化![]() 溶液变为血红色 结论:试液中含有Fe2+
溶液变为血红色 结论:试液中含有Fe2+
③试液![]() 白色沉淀
白色沉淀![]() 沉淀不溶解 结论:试液中含有
沉淀不溶解 结论:试液中含有![]()
④Ba(OH)2溶液![]() 溶液的导电能力先减弱后增强
溶液的导电能力先减弱后增强
结论:Ba(OH)2和H2SO4之间的反应是离子反应
![]()
⑥稀硫酸![]() 产生少量气泡
产生少量气泡![]() 产生大量气泡;
产生大量气泡;
结论:CuSO4是锌与稀硫酸反应的催化剂
(2)根据下图描述,回答下列问题:
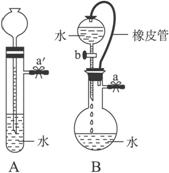
①关闭图A装置中的止水夹a′后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”“不漏气”或“不能确定”)____________。
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?(填“漏气”“不漏气”或“不能确定”)_________________,判断理由___________________________________。
查看答案和解析>>
科目: 来源: 题型:
A(g)+2B(g) ![]() 2C(g)
2C(g)
一段时间后达到平衡,生成a mol C。则下列说法中正确的是
A.物质A、B的转化率之比为1∶2
B.起始时刻和达平衡后容器中的压强比为(1+n)∶(1+n-![]() )
)
C.若起始时放入3 mol A和3n mol B,则达平衡时生成3a mol C
D.当v正(A)=2v逆(C)时,可断定反应已达平衡
查看答案和解析>>
科目: 来源: 题型:

A.O2-向电池的负极移动
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e-==4OH-
D.该电池的总反应方程式为2H2+O2![]() 2H2O
2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com