
科目: 来源: 题型:
A.硫酸生产中常采用高压条件提高SO2的转化率
B.合成氨中采用及时分离氨气提高反应速率
C.电解精炼铜时,溶液中c(Cu2+)基本保持不变
D.铝热反应常用于冶炼某些熔点较低的金属
查看答案和解析>>
科目: 来源: 题型:
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.乙醇与汽油组成元素相同,化学成分相似
C.乙醇汽油燃烧时,耗氧量高于等质量的汽油
D.乙醇可通过淀粉转化制得,是一种可再生的燃料
查看答案和解析>>
科目: 来源: 题型:
N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0

请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)= _________∶_________。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________________________。
(2)在t1时,曲线发生变化的原因是__________________、__________________。请计算氢气在t1起点时的坐标(_________,_________)以及在t2平衡时的坐标(_________,_________)。并在图中画出在t1—t2之间氢气的物质的量变化曲线。
(3)为达到图示中t2的平衡状态,在t1—t2之间需要采取的措施是_________。
a.扩大容器的体积
b.升高温度
c.降低温度
d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)= _________∶_________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)= _________∶_________。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
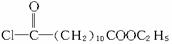
(R、R′均代表烃基)。
请回答下列问题:
(1)B物质的结构简式___________。
(2)写出转化①的化学方程式_________________________________________________;反应类型是___________。
(3)若转化④是通过若干个反应完成的,请设计由C→D的转化途径(用化学方程式表示):_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)相对分子质量为M2的酯的分子式为____________。
(2)饱和一元羧酸的化学式分别为____________、____________________________________。
(3)参加反应的醇结构简式为____________、____________、____________、____________(不必填满)。
(4)与相对分子质量为M1的酯互为同分异构体,能发生银镜反应、能与金属钠反应产生氢气的有机物的同分异构体有____________种。
查看答案和解析>>
科目: 来源: 题型:
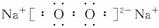
试回答下列问题:
(1)写出下列物质的化学式:A:____________,F:____________。
(2)写出B的电子式____________;A属于____________(填“极性”或“非极性”)分子。
(3)写出J→L的离子反应方程式_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5)。若用氧化物的形式表示,该化合物的化学式为____________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成![]() ,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式。
__________![]() +__________H2C2O4
+__________H2C2O4![]() __________VO++__________CO2+_______H2O
__________VO++__________CO2+_______H2O
其中还原剂是___________;若反应消耗0.9 g草酸,参加反应的钒元素质量是___________g。
查看答案和解析>>
科目: 来源: 题型:阅读理解
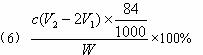
四种盐在不同温度下的溶解度(g/100 g水)表

(说明:①>35 ℃ NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是_________________________(填字母)。
(2)A装置中盛放的试剂是_________,其作用是____________________________________。
(3)在实验过程中,需要控制D温度在30—35 ℃,原因是___________________________。为了便于控制此温度范围,采取的加热方法为____________________________________。
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是____________。用蒸馏水洗涤NaHCO3晶体的目的是除去___________________________杂质(以化学式表示)。
(5)将锥形瓶中的产物过滤后,所得的母液中含有______________(以化学式表示),可加入氯化氢,并进行_________操作,使NaCl溶液循环使用,同时可回收NH4Cl。
(6)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c( mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:w(NaHCO3)=_________________。
查看答案和解析>>
科目: 来源: 题型:
①能用于干燥二氧化硫气体的装置有__________(填字母)。
②装置B除可用于制取CO2、H2,还可制取__________、__________。(写出两种物质的化学式)
③既能用于收集氯气又能用于收集一氧化氮气体的装置有__________。(填字母)

(2)下列实验操作或实验事实的叙述不正确的是_____________(填序号)。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体
B.在试管中放入几片碎滤纸片,加入几滴90%的浓硫酸,捣成糊状,微热并冷却后,先滴入几滴CuSO4溶液,再加入过量的NaOH溶液中和至出现Cu(OH)2沉淀。加热至沸腾,可观察到红色沉淀生成
C.制备硫酸亚铁晶体时,向废铁屑中加入过量稀硫酸,充分反应后,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体
D.测定硫酸铜晶体结晶水含量的实验中,称量操作至少要进行4次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com