
科目: 来源: 题型:
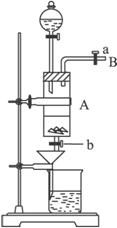
(1)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________________________________________________________。
(2)烧杯内放过量稀HNO3的原因是_______________________________________________,
发生反应的离子方程式是________________________________________________。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是________
____________________________________________________________________。
(4)利用这个装置进行实验,你认为该实验存在的缺点可能有:
__________________________,__________________________。(写两条即可)
(5)乙同学对该实验进行了改进,他是用空烧杯承接滤液,加入适当的试剂,然后在HCl的气流中、一定温度下蒸发、浓缩、降温结晶而得到纯净的FeCl3·6H2O,你认为加入的试剂可以是_____________。(填序号)①适量氯气 ②适量过氧化氢和稀盐酸 ③高锰酸钾酸性溶液 ④氢氧化钠溶液
在HCl的气流中、一定温度下蒸发、浓缩、降温结晶的理由是__________________________
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
方法一:将氨气通过灼热的氧化铜粉末,得到氮气和铜等。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
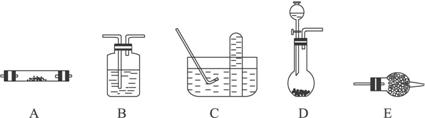
方法一有关装置如下图所示(其中有些仪器如:铁架台、铁夹、铁圈、石棉网、酒精灯等未画出):
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,应选用__________(填编号)作发生装置,该反应的化学方程式为______________________________。要制取并收集较纯净的氮气(可含有少量的水),还应使用上述装置中的(填装置的编号,并按气流方向从左向右列出)_____________________________________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。这两种方法与方法三相比,其优越性在于______________________________。
查看答案和解析>>
科目: 来源: 题型:
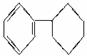
A.它们之间互为同系物
B.六星烷的分子式为C18H24
C.三星烷与丙苯互为同分异构体,四星烷与![]() 互为同分异构体
互为同分异构体
D.它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
科目: 来源: 题型:
![]()
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
查看答案和解析>>
科目: 来源: 题型:
A.溶液中四种离子之间不可能满足:c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
B.若溶液中粒子间满足:c(![]() )>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl、NH3·H2O
)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl、NH3·H2O
C.若溶液中粒子间满足:c(Cl-)>c(![]() )>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
D.若溶液中c(Cl-)=c(![]() ),则该溶液一定显中性
),则该溶液一定显中性
查看答案和解析>>
科目: 来源: 题型:
①pH之和为14的硝酸和氢氧化钾溶液 ②pH之和为15的盐酸和氨水溶液 ③pH之和为14的醋酸和苛性钠溶液 ④pH之和为13的硫酸和氢氧化钡溶液
A.② B.①② C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
A.6 mol B.8 mol C.10 mol D.12 mol
查看答案和解析>>
科目: 来源: 题型:
A.将162.5 g FeCl3转化为氢氧化铁胶体后,氢氧化铁胶体粒子数小于6.02×1023
B.在含196 g H2SO4的浓硫酸溶液中加入足量的锌粉使其充分反应,则反应结束时,转移电子数约为4×6.02×1023
C.在石墨晶体中,平均0.5 mol碳碳共价键所含有的碳原子数约为![]() ×6.02×1023
×6.02×1023
D.1 mol C10H22分子中共价键总数约为31×6.02×1023
查看答案和解析>>
科目: 来源: 题型:
如: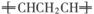
则对于有机物CH2=CHCH2CH=CH2发生烯烃复分解反应时可能生成产物的判断中正确的是①![]() ②CH2=CH2 ③
②CH2=CH2 ③![]()
A.①②③ B.①② C.③ D.③④
查看答案和解析>>
科目: 来源: 题型:
A.X3Y B.X2Y C.XY2 D.XY3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com