
科目: 来源: 题型:
(1)反应原理:C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O
NaHSO4+C2H5Br+H2O
(2)主要装置见下图
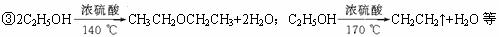
(3)操作步骤
①在100 mL圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%硫酸,然后加入研细的13 g溴化钠。②加入几粒碎瓷片,小心摇动烧瓶使其均匀。将烧瓶与直形冷凝管相连,冷凝管下端连接接受器。③小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷流出为止。④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?________________________________。
②亚硫酸钠溶液的作用是____________________________________________________。
③该实验中会产生许多生成有机物的副反应,写出化学方程式:________________________________(举一例)。
④本次实验只收集到5 mL溴乙烷,比理想产量约10 mL少,原因是溴乙烷易挥发的缘故,为了减少其损失,你认为可采取什么措施?________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)化学实验必须注意安全,下列做法存在安全隐患的是___________(选填字母)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300 ℃的温度计代替量程为200 ℃的温度计,测反应液的温度
(2)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-====![]() ,又知氧化性:Fe3+>Cu2+>I2>
,又知氧化性:Fe3+>Cu2+>I2>![]() 。
。
析出的I2可用c mol·L-1 Na2S2O3标准溶液滴定:2![]() +
+![]() ====
====![]() +3I-。
+3I-。
准确称取a g胆矾试样,置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol·L-1 H2SO4溶液,加少量NaF,再加入足量的10% KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入1—2 mL 05%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是:______________________。
②实验中加入5 mL 3 mol·L-1 H2SO4溶液,你认为硫酸的作用是:_______________________。
③本实验中用碘量瓶而不用普通锥形瓶是因为:_____________________________________。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:____________________________________________________________________。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数为w(Cu)=______________。
查看答案和解析>>
科目: 来源: 题型:
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有______________(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架 E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是________________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用(填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是____________________________________________________________ 。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
查看答案和解析>>
科目: 来源: 题型:
A.c(Na+)+c(H+)>c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
B.c(Na+)>c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
C.若c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+),则一定a<b
)>c(OH-)>c(H+),则一定a<b
D.若c(![]() )+2c(OH-)=2c(H+)+c(
)+2c(OH-)=2c(H+)+c(![]() )+3c(H2CO3),则可确定a=b
)+3c(H2CO3),则可确定a=b
查看答案和解析>>
科目: 来源: 题型:
Ⅰ将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a。
Ⅱ若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是( )
A.若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大
B.若向Ⅰ平衡中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B)====n (A)+3
D.若Ⅱ体系起始物质的量当满足3n(C)+8n(A)=12n(B)时,可断定x=4
查看答案和解析>>
科目: 来源: 题型:
A.青石棉是一种易燃品且易溶于水
B.青石棉的化学组成用氧化物形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1 mol Na2Fe5Si8O22(OH)2与足量硝酸作用,至少需消耗6 L 3 mol·L-1 HNO3溶液
D.1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗55 L 2 mol·L-1 HF溶液
查看答案和解析>>
科目: 来源: 题型:
(1)富集,将硫化物矿进行浮选;
(2)焙烧,主要反应为2CuFeS2+4O2====Cu2S+3SO2+2FeO(炉渣);
(3)制粗铜,在1 200 ℃发生的主要反应为:2Cu2S+3O2====2Cu2O+2SO2;
2Cu2O+Cu2S====6Cu+SO2↑;
(4)电解精炼。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2
C.在反应2Cu2O+Cu2S====6Cu+SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源正极相连
查看答案和解析>>
科目: 来源: 题型:
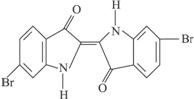
A.泰雅紫分子的分子式为:C16H8N2Br2O2
B.泰雅紫不存在同分异构体
C.泰雅紫属于烃的衍生物
D.检验泰雅紫中溴元素可直接加入硝酸银溶液,看是否有浅黄色沉淀
查看答案和解析>>
科目: 来源: 题型:
A.X、Y可能都是金属
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y处于同一周期,则化合物M可能是非极性分子
D.X、Y两元素周期数相差1,属于离子化合物的M只有三种
查看答案和解析>>
科目: 来源: 题型:
A.正极材料是锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应为:V2O5+xe-+xLi+![]() LixV2O5
LixV2O5
D.负极的电极反应为:xLi-xe-![]() xLi+
xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com