
科目: 来源: 题型:
A.1 L 1 mol·L-1 CH3COONa溶液中存在NA个CH3COO-离子
B.1 mol CnH2n+2含有(3n+1)NA个共价键
C.1 mol Cl2参加化学反应获得的电子数都是2NA
D.1 mol NO2气体降温后颜色变浅,其所含的分子数仍为NA
查看答案和解析>>
科目: 来源: 题型:
A.定性检验![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有![]() 时,在无其他阳离子干扰的条件下,用盐酸酸化后加BaCl2溶液
时,在无其他阳离子干扰的条件下,用盐酸酸化后加BaCl2溶液
查看答案和解析>>
科目: 来源: 题型:
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔化状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
查看答案和解析>>
科目: 来源: 题型:
①取一高度腐蚀的干燥铁钉,称其质量为1004 g,在氮气保护下,充分加热,冷却后称得质量为892 g。
②将①得到的残渣投入到500 mol·L-1的硫酸中,不断添加硫酸直到残渣完全溶解时,恰好用去硫酸3100 mL。整个过程中无气体放出。试回答下列问题:
(1)铁锈中是否含有碳酸亚铁?理由是什么?
(2)锈蚀的铁钉中含Fe2O3·H2O多少克?
(3)锈蚀前铁钉的质量至少是多少克?
查看答案和解析>>
科目: 来源: 题型:
(1)探究裂化气的热值
已知:
气体 | CH4 | C2H6 | C2H4 | C3H6 |
燃烧热/kJ·mol-1 | Q1 | Q2 | Q3 | Q4 |
①若448 L(标准状况)裂化气充分燃烧放出热量Q kJ,则Q的取值范围介于:______________________(用Q1、Q2、Q3、Q4表示,下同)。
②若将448 L气体(标准状况)缓缓通过盛有足量溴的四氯化碳溶液中,发现洗气瓶增重336 g。则448 L(标准状况)气体完全燃烧放出的热量Q=_____________kJ。
(2)测量与H2加成反应后气体总体积与氢气的体积分数关系
另取裂化气与H2混合得5 L混合气体,已知其中H2的体积分数φ(H2)=X,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与X的函数关系式。___________________
______________________________________。
查看答案和解析>>
科目: 来源: 题型:
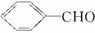
试回答下列问题:
(1)写出结构简式:D______________,F______________。
(2)上述属于取代反应的有______________(选填序号)。
(3)写出反应⑤的化学方程式:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)C1化学是指从一个碳原子的化合物(如CH4,CO,CO2,CH3OH,HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和洁净燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO与H2按一定比例可生成乙二醇,则n(CO)/n(H2)=_____________(填数字)。
②若汽油平均组成用CmHn表示,则合成汽油控制n(CO)/n(H2)=(用m、n表示)。
③甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚可生成高分子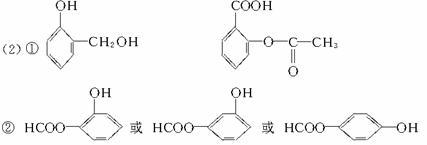 写出生成A的化学方程式:_________________________________。
写出生成A的化学方程式:_________________________________。
(2)已知醇醛在一定条件下能发生缩合反应,示例如下:
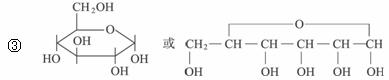
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C。
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6。
③C遇氯化铁溶液能发生显色反应,1 mol C与足量钠反应可产生1 mol H2。
④C在适当的条件下用适当氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应。
⑥D与乙酸酐〔(CH3CO)2O〕反应,可得常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
①写出结构简式:C_________________,E_________________。
②写出与D互为同分异构体,含有苯环且含有酯结构的结构简式:_________________(只需写一种)。
③B通常以六元环状结构存在,写出B的环状结构简式:_________________________。
查看答案和解析>>
科目: 来源: 题型:

试回答下列问题:
(1)G的化学式为:___________________。
(2)写出下列反应的化学方程式:
①________________________________________________________________;
②________________________________________________________________。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量的比为3∶8,则X的化学式为:__________;X与盐酸反应的化学方程式:___________________。
查看答案和解析>>
科目: 来源: 题型:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是__________(填字母)。
A采用较高压强(20—50 MPa)
B采用500 ℃的高温
C用铁触媒作催化剂
D将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)下图是实验室模拟工业法合成氨的简易装置。简述检验有氨气生成的方法:______________________________________________________。
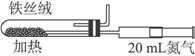
(3)在298 K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924 kJ?
___________________________________________________________________。
(4)1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
阴极的电极反应式为:__________________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com