
科目: 来源: 题型:
A.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
C.“百炼成钢”的化学含义是使用氧化剂提高生铁中碳的含量
D.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
查看答案和解析>>
科目: 来源: 题型:
①用天然气代替汽油和柴油作为发动机燃料 ②开发生产无汞电池 ③提倡使用一次性发泡塑料餐具和塑料袋 ④分类回收垃圾 ⑤开发利用无磷洗涤剂
A.①③④ B.②③④⑤ C.①②④⑤ D.全部
查看答案和解析>>
科目: 来源: 题型:
(1)确定该合金的化学式_____________。
(2)若晶体的密度为ρ g·cm-3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为_____________cm。
(3)取该合金粉末2.78 g溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L(标准状况)NO气体(设两者恰好完全反应),则原硝酸溶液的物质的量浓度为__________ mol·L-1,反应后溶液中Fe3+离子的物质的量浓度为_____________mol·L-1(假定溶液体积变化忽略不计)。

查看答案和解析>>
科目: 来源: 题型:
5I-+![]() +6H+====3I2+3H2O
+6H+====3I2+3H2O
2Cu2++4I-====2CuI+I2
反应后,用0.22 mol·L-1 Na2S2O3溶液滴定(I2+2![]() ====2I-+
====2I-+![]() ),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少。
),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少。
查看答案和解析>>
科目: 来源: 题型:

请按要求回答:
(1)写出石灰氮的化学式_____________。
(2)写出反应①的化学方程式_____________________________________________。
(3)除反应②③④⑤是应用于工业生产外,还有两个是应用于工业生产的反应,是_________和___________(填代号),它们反应的化学方程式分别是______________________________和_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
CuO+2HCl====CuCl2+H2O,FeO+2HCl====FeCl2+H2O。
已知:一般地,pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥4.4时,Cu2+开始以Cu(OH)2的形式沉淀;pH≥6.4时,Cu2+以Cu(OH)2形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是______________________________;
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液的pH变化是___________;
(3)若此溶液中杂质只有Fe3+时,要调整pH在3—4之间,此时最好向溶液中加入___________。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lgc(Cu2+)=8.6-2pH,若某溶液中c(Cu2+)为1 mol·L-1,要保证此溶液中Cu2+刚好不发生沉淀,则溶液的pH应为___________,此时溶液中的铁离子能否沉淀完全___________(填“能”或“否”)。
查看答案和解析>>
科目: 来源: 题型:
(1)写出元素符号:丙:____________,丁:____________。
(2)写出甲、乙两种元素形成的含有非极性键的极性分子的电子式______________________________________。
(3)写出2种均含甲、乙、丙、丁四种元素的化合物相互反应逸出气体的化学方程式:_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
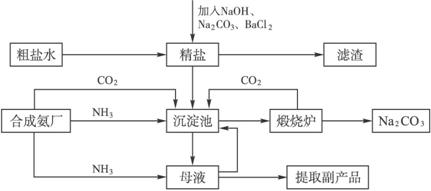
(1)为了有效除去精盐中含有的少量Ca2+、Mg2+、![]() 等杂质,加入试剂的合理顺序为___________(填字母)。
等杂质,加入试剂的合理顺序为___________(填字母)。
a.先加NaOH,后加Na2CO3,再加BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
c.先加BaCl2,后加NaOH,再加Na2CO3
(2)为检验Na2CO3产品中是否含有氯化钠,可取少量试样溶于水后,再滴加___________,此实验中所需的仪器有药匙、___________。
(3)所得纯碱中含有NaCl杂质,若起始时取纯碱试样a g、U形管(装有碱石灰)的质量为b g,请你利用下列装置完成纯碱试样中Na2CO3的质量分数的测定。
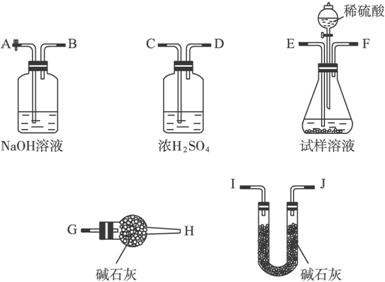
①实验时,装置的连接顺序从左到右依次为(填各装置导管口的编号):A__________。
②在反应前要从A处缓缓鼓入一定量空气后再连接U形管等仪器的目的是_____________________________________________;在反应后若不从A处缓缓鼓入一定量空气将导致测定结果_________________(填“偏大”“偏小”或“不变”)。
③若反应完全后最终U形管的质量为c g,则试样中Na2CO3的质量分数的计算式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
操作 | 现象 | 结论或离子方程式 |
①取少量明矾放入烧杯中,加适量蒸馏水,并搅拌,配成稀溶液;在三支试管中分别加入约0.5 mL稀明矾溶液 | — | — |
②在第一支试管中滴加NaOH溶液至过量 | 溶液中的现象是____________ | 反应的离子方程式:______________________ |
③在第二支试管中滴加______________________________ | 溶液中有白色沉淀产生 | Ba2++ |
④对第三支试管溶液用______________________________ | _______________ | 证明有K+ |
⑤另取少量明矾晶体,放入一支干燥试管中,用酒精灯加热 | 在试管内壁和管口有水珠产生 | 证明有结晶水 |
(2)在常温下,取两片质量相等、外形相同、表面经过砂纸打磨(完全除掉了氧化膜)的铝片,分别加入到盛有相同体积、c(H+)均为3 mol·L-1的稀硫酸和稀盐酸溶液的两支试管中,发现铝片在稀盐酸中产生氢气的速率明显比在稀硫酸中快。请你对上述现象产生的原因提出假设并设计实验方案来验证你的假设。
你的假设是:假设一:__________________________;假设二:________________________。
你设计的实验方案是:______________________________。
查看答案和解析>>
科目: 来源: 题型:
A.用10 mL量筒准确量取稀硫酸溶液8.0 mL
B.用干燥的pH试纸测定氯水的pH
C.用碱式滴定管量取KMnO4溶液19.60 mL
D.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E.将饱和FeCl3溶液滴入蒸馏水中即得Fe(OH)3胶体
F.圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
(2)用50 mL 0.5 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液进行中和热的测定实验,请回答下列问题:
①在实验中使用的仪器除大烧杯、小烧杯、环形玻璃搅拌棒、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)外,还必须要用到的仪器有___________________________。
②要想提高中和热测定的准确性,可采用的措施除以下列出的三种以外,请你再写出三种:
a.如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平。
b.盐酸和NaOH溶液浓度的配制要准确,且NaOH溶液的浓度须稍大于盐酸的浓度。
c.实验操作时动作要快,注意不要将溶液洒到外面。
d.__________________________________________________________。
e.__________________________________________________________。
f.__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com