
科目: 来源: 题型:
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为______________。
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______________,或NO和______________(填它们的分子式)。
(3)在其他条件不变的情况下,若改为起始时在1 L容器中充入2 mol NO2和2 mol SO2,则上述两反应达到平衡时,c平(SO2)=______________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:

(1)实验时除需测定粗锌的质量、氢气的体积之外,是否还需要其他物理量?如需要,请指出_______________________,否则,此空不填。
(2)实验时在检查装置气密性后,如何将试剂加入试管并使反应开始?_______________。
(3)以下是测量收集到气体体积必须包括的几个步骤:①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是:_______________________(请填写步骤代号)。
(4)测量收集到气体体积(图中夹持仪器已省略)时,如何使量筒内外液面的高度相同?______________________________________________。
(5)如果实验中测得粗锌质量为a g,得到的氢气体积是b L(已折算成标准状况),水蒸气的影响忽略不计,粗锌中锌的质量分数的计算式为(含a、b,不必化简):___________________。
(6)试根据上述仪器,提出更简捷的实验方案:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
①置于酒精灯上小火加热(在通风厨中进行) | 有红棕色气体逸出,继续加热,直到不再有红棕色气体逸出为止。溶液的黄色变浅,但不能完全消失 |
②通入氧气 | 通入足量氧气后,上述工业硝酸黄色变浅 |
③加入5 mL的蒸馏水,振荡使之充分混合 | 试管中的硝酸接近于无色 |
说明:在①②实验后的溶液中加入各1 mL苯,充分振荡,静置,苯层为无色,下层仍为浅黄色。
(1)根据上述实验①②的现象你能得出什么结论?___________________________________。
(2)①②实验最终溶液是浅黄色,请猜想可能原因_______________________,试设计实验方案证明你的猜想_____________________________________。
(3)实验③与实验①②最终实验颜色不同的原因可能是_______________________,试设计实验方案证明______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.-Y kJ·mol-1 B.-(10X-Y) kJ·mol-1
C.-(5X-0.5Y) kJ·mol-1 D.+(10X-Y) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
④0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
A.四种溶液中c(HA-)浓度大小:③>①>②>④
B.溶液①中粒子浓度大小顺序是:c(H2A)>c(H+)>c(HA-)>c(A2-)>c(OH-)
C.溶液②中有关离子浓度关系:c(HA-)+2c(A2-)+c(H2A)=c(Na+)
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目: 来源: 题型:

A.该物质易溶于水
B.M能发生加聚反应
C.M的分子式为C13H12O2NF4
D.M分子内至少有13个碳原子在同一平面内
查看答案和解析>>
科目: 来源: 题型:
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:![]() +OH-====NH3·H2O
+OH-====NH3·H2O
B.Fe(OH)3与氢碘酸溶液混合:Fe(OH)3+3H+====Fe3++3H2O
C.电解精炼铜的阴极反应是:Cu2++2e-====Cu
D.1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl等体积互相均匀混合:2![]() +5H+====Al(OH)3↓+Al3++H2O
+5H+====Al(OH)3↓+Al3++H2O
查看答案和解析>>
科目: 来源: 题型:
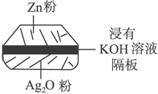
根据以上提供的资料,判断下列说法正确的是
A.锌为负极,Ag2O为正极
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
查看答案和解析>>
科目: 来源: 题型:
A.加入纯Cu将Fe2+还原
B.向溶液中加入(NH4)2S使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2,再加入CuO粉末调节pH为4—5
查看答案和解析>>
科目: 来源: 题型:
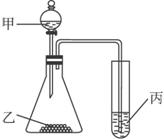
A.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
证明酸性:盐酸>H2CO3>C6H5OH
B.甲:盐酸,乙:硫化亚铁,丙:溴水。
证明还原性:S2->Br->Cl-
C.甲:水,乙:电石,丙:溴水。
证明稳定性:H2O>C2H2>Br2
D.甲:浓盐酸,乙:高锰酸钾,丙:溴化钾溶液。
证明氧化性:KMnO4>Cl2>Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com