
科目: 来源: 题型:
2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)T1℃下反应达到平衡时,测得容器内n(SO3)=1.3 mol,n(O2)=3.0 mol,则a=________;平衡时SO2的转化率为________。
(2)T2℃下反应达到平衡时,混合气体的物质的量共为4.8 mol。T1与T2的关系是________ (选填序号)。
①T1>T2 ②T1<T2 ③T1=T2
查看答案和解析>>
科目: 来源: 题型:

图1-2-24
(1)电解时F极发生_________反应,电极反应式为__________________;E极发生反应,电极反应式为___________________________;
(2)电解时电解池中产生的现象是__________________,电解后持续通入CO2产生的现象是____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
N2(g)+3H2(g)![]() 2NH3(g),673 K、30 Mpa下,n(NH3)和n(H2)随时间变化的关系如图1-2-23所示,下列叙述正确的是( )
2NH3(g),673 K、30 Mpa下,n(NH3)和n(H2)随时间变化的关系如图1-2-23所示,下列叙述正确的是( )
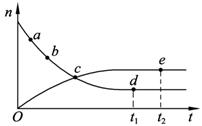
图1-2-23
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
查看答案和解析>>
科目: 来源: 题型:
A.正极反应式为:O2+2H2O+4e-====4 OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
查看答案和解析>>
科目: 来源: 题型:
A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c(Na+)=2c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,c(Na+)=c(CH3COO-)
D.常温下,pH=1的溶液中,Fe2+、I-、ClO-、![]() 能够大量共存
能够大量共存
查看答案和解析>>
科目: 来源: 题型:
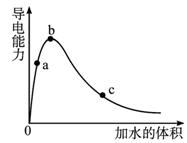
图1-2-22
A.a,b,c三点溶液的pH:c<a<b
B.a,b,c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏大
D.a,b,c三点溶液用1 mol·L-1的氢氧化钠溶液中和,消耗氢氧化钠溶液的体积:c<a<b
查看答案和解析>>
科目: 来源: 题型:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是?( )?
A.L、R的单质与稀盐酸反应的速率:L<R
B.M与T形成的化合物有两性
C.Q、T两元素的氢化物分子间都存在氢键
D.L、Q形成的简单离子核外电子数相等
查看答案和解析>>
科目: 来源: 题型:
A.同一主族的元素,原子半径越大,其单质的溶点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
查看答案和解析>>
科目: 来源: 题型:
A.![]() 表示Am元素的相对原子质量一定为243
表示Am元素的相对原子质量一定为243
B.![]() 表明其原子核内含有的中子数为95
表明其原子核内含有的中子数为95
C.X元素的原子核内中子数应为176,核外电子数应为118
D.X元素的原子的质量数应为288,核内质子数应为115
查看答案和解析>>
科目: 来源: 题型:
A.粗铜接电源负极
B.纯铜作阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56 g,电路中通过电子为0.04 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com