
科目: 来源: 题型:阅读理解
(1)将漂粉精溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的离子方程式为____________________。另取少许上层清液,先滴加适量的_________ (填化学式)酸化,再滴加_________(填化学式)溶液即可检验Cl-的存在,发生反应的离子方程式为____________________。再取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂粉精溶液呈__________性并具有__________性。
(2)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl====2Cl2↑+CaCl2+2H2O
该反应中,每生成1 mol Cl2,转移电子物质的量为__________,被氧化的HCl的物质的量为__________。
有效氯是漂粉精中有效成分Ca(ClO)2的含量大小标志,已知:有效氯
=![]() ×100%
×100%
若某漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数=___________。
(计算结果保留小数点后1位。已知相对分子质量用Mr表示:Mr(Cl2)=71,Mr[Ca(ClO)2]=143)
(3)现用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精,甲、乙、丙三人分别设计三个实验装置,如图1-3-1所示。已知Cl2与Ca(OH)2制漂粉精的反应是放热反应,而在较高温度下即发生如下反应:
6Cl2+6Ca(OH)2====5CaCl2+Ca(ClO3)2+6H2O

图1-3-1
①请指出三个装置各自的缺点或错误(如没有可不填):
甲____________________________________________________________,
乙____________________________________________________________,
丙____________________________________________________________。
②图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置__________ (填所选部分的编号)。
③实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________ (假定各步反应均无反应损耗且无副反应发生)。
查看答案和解析>>
科目: 来源: 题型:
(1)下列各组类比中正确的是( )
A.由NH4Cl![]() NH3↑+HCl↑ 推测:NH4I
NH3↑+HCl↑ 推测:NH4I![]() NH3↑+HI↑
NH3↑+HI↑
B.由CO2+Ca(ClO)2+H2O====CaCO3↓+2HClO 推测:SO2+Ca(ClO)2+H2O====CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O====Ca(HCO3)2+2HClO 推测:CO2+NaCIO+H2O====NaHCO3+HClO
D.由Na2SO3+2HCl====2NaCl+H2O+SO2↑ 推测:Na2SO3+2HNO3====2NaNO3+H2O+SO2↑
(2)根据2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑的反应原理例举一个制取类似气体的反应(写出方程式)________________________________________。
Na2SO4+2HCl↑的反应原理例举一个制取类似气体的反应(写出方程式)________________________________________。
(3)由氢氧化铁与盐酸反应生成氯化铁和水,应用有关知识,推断氢氧化铁与氢碘酸的化学方程式____________________________________________。
(4)从2F2+2H2O=====4HF+O2反应,预测2F2+4NaOH====4NaF+2H2O+O2,然而经过实验,物质的量相等的氟气和氢氧化钠正好完全反应,生成氟化钠、水和放出一种气体,请根据实验结果写出化学方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)纯净物B的化学式为_____________________;?
(2)A中是否含有NaCl_________(填写“有”或“没有”),理由是什么(通过计算回答)?
(3)若反应后还生成1.008 L(标准状况)一种气体,且该气体不会使品红褪色。求所取的A样品中含有Na2S的物质的量。
查看答案和解析>>
科目: 来源: 题型:
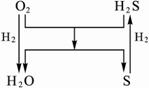
请回答下列问题:?
(1)若Y是水,甲、乙是同族元素的单质,写出甲和X反应的化学方程式____________。
(2)若X是水,写出甲和X反应的化学方程式_________________________________。
(3)若X、Y均为氧化物,其中X常温下为气态,Y常温下为固态,则甲为_______,乙为________,丙为_________。
(4)若X、Y均为氧化物,其中X常温下为固态,Y常温下为气态,则X为___________(填晶体类型)晶体;Y为___________(选填“酸性”“碱性”“两性”“不成盐”)氧化物。??
查看答案和解析>>
科目: 来源: 题型:
已知:CO2+3H2O+2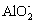 ══2Al(OH)3↓+CO
══2Al(OH)3↓+CO![]()
(1)这五种溶液的pH由小到大的顺序是:________(填编号)。?
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是:________(填编号)。?
(3)在上述五种溶液中分别加入AlCl3溶液,能产生无色无味气体的是:________(填编号)。
(4)将上述①②③④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式: 。?
查看答案和解析>>
科目: 来源: 题型:
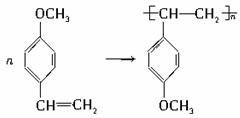
(1)请写出A中含氧官能团的名称: ;
(2)请写B~E物质中与A互为同分异构体的是(用编号回答。下同):_______;?
(3)A、B、C三物质的酸性由强到弱的排列顺序是: 。
(4)在A~E中,能通过加聚反应生成高聚物的是:______________________________。
查看答案和解析>>
科目: 来源: 题型:
![]()
请回答下列问题:?
(1)装置A的大试管内发生反应的离子方程式为:________________________________。(2)装置A中能否省去盛饱和NaCl溶液的洗气瓶?理由是:____________________________。
(3)装置A中能否省去盛浓硫酸的洗气瓶?理由是:________________________________。
(4)装置A中能否省去盛冰水的烧杯?理由是:____________________________________。
(5)装置B中制备时发生的电解反应的化学方程式为:______________________________。
(6)装置B中a端应接电源的极,理由是:________________________________________。
查看答案和解析>>
科目: 来源: 题型:
①称取某纯碱样品10.0 g放入烧杯中,并加适量蒸馏水使之完全溶解;?
②____________________________________;?
③____________________________________;?
④用蒸馏水洗涤沉淀2~3次;?
⑤将沉淀烘干、称量,测得固体质量2.87 g。?
(1)补齐所缺少的实验步骤,将答案填写在上面②和③的空格处。?
(2)实验步骤③所用的玻璃仪器有:______________________________________________;
(3)在过滤器上洗涤沉淀的具体操作是:__________________________________________;
(4)检验沉淀是否洗涤干净的方法是:____________________________________________;
(5)若纯碱标签上标注:“Na2CO3含量≥80.0%,NaCl含量≤20.0%”,则此样品是否合格?(填“合格”或“不合格”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com