
科目: 来源: 题型:
A.酸跟碱中和生成1 mol H2O时放出的热量
B.稀溶液中,酸跟碱发生中和反应时的反应热
C.在稀溶液中,1 mol强酸跟强碱发生中和反应生成H2O时的反应热
D.常温时,当强酸跟强碱在稀溶液中发生中和反应时,每生成1 mol H2O,都放出57.3 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
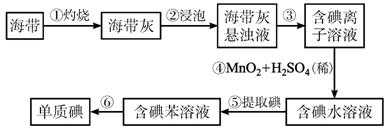
图1-5-9
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)步骤④反应的离子方程式是_______________________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___________________________________。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______________。
查看答案和解析>>
科目: 来源: 题型:
(1)制备氧化铜
![]() CuSO4·5H2O……CuO
CuSO4·5H2O……CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是___________________________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是_________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是__________________。水浴加热烘干。水浴加热的特点是___________________________________________________________。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是____________________________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________。
查看答案和解析>>
科目: 来源: 题型:
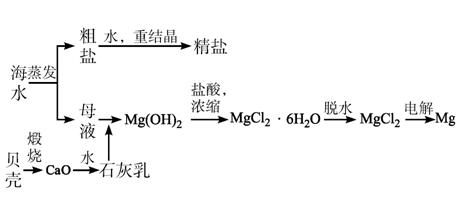
图1-58
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式____________________________________________________________________。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O能得到无水MgCl2,其原因是______________________________________________________。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(3)实验室里将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:_______________________________________________________________;
过滤时:_______________________________________________________________;
蒸发时:_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
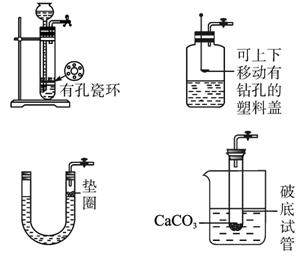
图1-5-5
(2)若用上述装置制取CO2气体,而实验室只有H2SO4、浓HNO3、水、块状纯碱、块状石灰石,比较合理的方案应选用的药品是__________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.加NaOH溶液 B.加盐酸 C.加硝酸D.加热 E.加AgNO3溶液 F.加水过滤 G.加MnO2 H.置于空气中(填序号,可重复选择。已知卤代烃在碱性条件下受热水解可生成卤化物)
(1)证明一种金属粉末是铁粉的操作顺序是_________________________________________。
(2)证明KClO3中含有氯元素的操作顺序是_________________________________________。
(3)证明2氯丙烷中含有氯元素的操作顺序是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)反应过程中,固体产物的质量是否可能为10.0 g________ (填“可能”或“不?可能”)。
(2)若实验没有误差,反应完全后,将气体产物除去水后,其物质的量n(气体)的取值范围为________。
(3)某同学在实验中最后获得固体的质量为7.6 g,试计算该同学获得固体物质的组成成分和它们的质量。
查看答案和解析>>
科目: 来源: 题型:
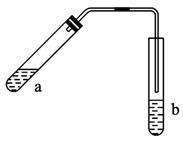
图1-54
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,
正确的加入顺序及操作是___________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是____________________。
(3)实验中加热试管a的目的是:
①_________________________________________________________________;
②_________________________________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是______________________________________。
(5)反应结束后,振荡试管b,静置,观察到的现象是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com