
科目: 来源: 题型:
已知:2CxHy+(4x+y)CuO![]() 2xCO2+(4x+y)Cu+yH2O
2xCO2+(4x+y)Cu+yH2O
(1)若只测定SO2气体,必须选用的装置是____________ (填装置序号,下同);若只测定混合气体中的CO2,必须选用的装置有________________________。
(2)若四种气体分别依次通过③④①②⑤和③④⑤②①,是否都可测量出四种气体的质量分数?____________(填“能”或“不能”)。
(3)若混合气体总质量为m g,分别依次通过③④①②⑤,实验②装置减少m1 g,?⑤装置增重m2 g,则原混合气体中CH4的质量分数w(CH4)= ____________。
(4)若将混合气体中甲烷换成乙烯,其他不变(已知:3CH2==CH2+2MnO4(稀)+4H2O![]()
3CH2OH—CH2OH+2KOH+2MnO2↓),设每次原混合气体取样均为m g,只选用装置中的③、④、⑤,能否测定混合气体中SO2的质量分数?_________ (填“能”或“不能”)。如果能,请简要写出你的设计方案和结果:_____________________________________________;如果不能,此空格不必填。
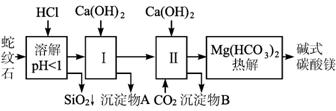
图1-5-20
查看答案和解析>>
科目: 来源: 题型:
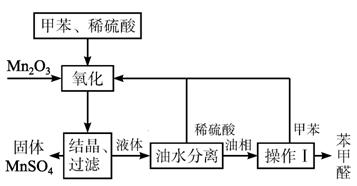
图1-5-19
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是____________________________________________________________________。
(3)实验过程中,可循环使用的物质分别为________、________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是________,其原理是________。
(5)实验中发现,反应时间不同,苯甲醛的产率也不同(数据见下表)。
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲酸的结构,分析当反应时间过长时,苯甲醛产率下降的原因__________________
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
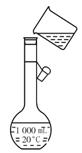
图1-5-18
![]()
![]()
(1)判断BaCl2已过量的方法是________________________________________________。
(2)第④步中,相关的离子方程式是____________________________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是____________________
_____________________________________________________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,图1-5-18是该同学转移溶液的示意图,图中的错误是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
图1-5-17是实验室制备TiCl4的反应装置,主要操作步骤为:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。

图1-5-17
试完成下列各题:
(1)正确的操作顺序为(填序号)_______________________________________________。
(2)装置A中的反应的离子方程式为__________________________________________。
(3)操作①的目的是_________________________________________________________。
(4)装置D中冷凝管进水口的位置是________(填a或b),装置E的作用是________________
____________________________________________________________________。
(5)TiCl4露置于空气中极易水解,其化学方程式可表示为_________________________。
(6)工业上常用金属镁在800℃和氩气氛围中还原TiCl4的方法制备钛,TiCl4+2Mg![]()
Ti+2MgCl2,氩气的作用为___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)从图1-5-15中挑选所需的仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
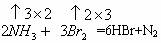
图1-5-15
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为__________________。
(3)为验证:“同温同压下,相同体积的任何气体都含有相同的数目的分子”,该小组同学设计了如下图1-5-16所示的装置,图中B管的容积是A管的2倍。活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好)。
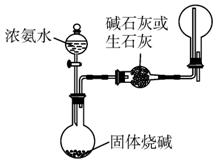
图1-5-16
①在A管中充满与大气压强相等的干燥HCl气体。操作是__________________。控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3。
②缓慢开启活塞K3,A管中的现象是__________________。要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是__________;若观察不到预期现象,主要原因是_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
现将0.39 g过氧化钠溶解在10.0 mL水中,再向其中加入2滴酚酞,先变红,片刻后红色褪去。
(1)甲同学认为红色褪去的原因是由于所得的溶液中c(OH-)比较大,这种说法_________(填“正确”或“不正确”),说明理由:_____________________________________________。
(2)乙同学认为红色褪去的原因可能是由于反应中有过氧化氢生成,这种说法_________(填“正确”或“不正确”),并通过a.分析推理 b.提出假设 c.设计实验来说明理由。
a. _______________________________________________________________;
b. _______________________________________________________________;
c. _______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
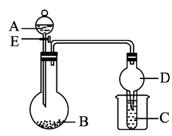
图1-5-14
(1)若A为浓硫酸;B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液。实验中观察到溶液褪色,则B是_____________(写化学式),B与浓H2SO4反应的化学方程式为_____________。反应后往烧杯中加入沸水,又可观察到试管C中的现象为__________________________。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是____________________。然后往烧杯中加入沸水,可观察到试管C中的现象是___________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是_____________ (写名称),C是_____________ (写化学式)与葡萄糖的混合液。该反应的离子方程式为_____________,仪器D在此实验中的作用是__________________________。
查看答案和解析>>
科目: 来源: 题型:
利用图1-5-13所示装置(暂不考虑尾气的吸收),选用中学化学常见试剂设计两个实验,将所用试剂名称、丙中现象及由此得出的实验结论(可以是单一物质的性质,也可以是不同物质性质比较)填入下列空白处:

图1-5-13
(1)[实验一]
所用试剂:甲__________、乙__________、丙__________。
丙中现象:____________________________________________________________。
实验结论:____________________________________________________________。
(2)[实验二]
所用试剂:甲__________、乙__________、丙__________。
丙中现象:____________________________________________________________。
实验结论:____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
其中X装置供选用的试剂有:
A.浓硫酸 B.食盐溶液 C.浓硝酸 D.二氧化锰 E.氯酸钾 F.双氧水G.浓盐酸
Y装置供选用的试剂有:
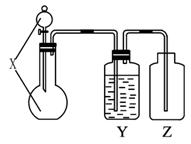
图1-5-12
①浓硫酸 ②氢氧化钠溶液 ③饱和食盐水
(1)根据题目要求填写表格:
项目 气体 | X装置选用试剂(填序号) | Y装置选用试剂(填序号) | X装置中发生主要反应的化学方程式或反应原理 |
氧气 |
|
|
|
氯化氢 |
|
|
|
(2)利用上述装置制取氯气,X装置中选用的试剂是_________(填序号);若要制取纯净、干燥氯气,在X和Y装置之间还需要增加_______装置,该装置中所加试剂是_______(填序号)。
(3)利用上述装置,任意选择试剂,还可制取其他气体,例如制取_________,此时X装置中选用的试剂名称是_________。
查看答案和解析>>
科目: 来源: 题型:

图1-5-11
将17 g Na2CO3溶于80 mL水中,分装在C、D中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓硫酸和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得的溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试完成:
(1)如何配制60 mL浓硫酸与10 mL水的混合液?
答:_________________________________________________________________。
(2)装置B中浓硫酸的作用:____________________________________________________
_____________________________________________________________________。
(3)Na2CO3溶液要分装在C、D两瓶中的理由是______________,发生反应的离子方程式为_____________________________________________________________________。
(4)控制SO2产生速率的方法是___________________________________________________
_____________________________________________________________________。
(5)通SO2结束后,加Na2CO3的目的是___________________________________________
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com