
科目: 来源: 题型:
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce (SO4)2溶液。有关化学反应为:
Fe3+CuCl====Fe2++Cu2++Cl-
Ce4++Fe2+====Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
科目: 来源: 题型:
A.1∶2∶3 B.3∶2∶1
C.1∶3∶2 D.2∶3∶1
查看答案和解析>>
科目: 来源: 题型:
(1)F位于___________周期,____________族;
(2)G的离子结构示意图__________________________________;
(3)用电子式表示D的形成过程________________________________;
(4)由A、E、F三种元素形成的化合物的化学式为__________,含有的化学键有__________(填写完整化学键类型),属于____________晶体;
(5)B的最高价是___________,由A、B组成的化合物中,含A量最高的物质的化学式是__________,含B量最高的物质的化学式是____________(写出两种)。与D2式量相等的物质的化学式是__________,含有的化学键有__________(填写完整化学键类型),属于__________晶体,有___________对共用电子对。
查看答案和解析>>
科目: 来源: 题型:阅读理解
2CNO-+3ClO-+2 H+====N2↑+2CO2↑+3Cl-+H2O。某科研部门用图1-5-25所示装置进行模拟实验,以证明上述处理CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置通过测定CO2的量来确定CN-的处理效果。
试根据要求完成下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.50 mol·L-1)20 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。乙装置中生成的气体除含有CO2、N2、HCl外,还有副反应生成的Cl2等物质,写出生成Cl2的副反应的离子方程式:_____________________________________________。
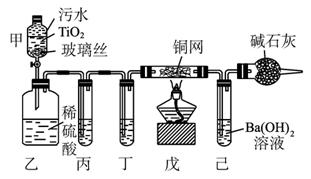
图1-5-25
(2)丙中加入的除杂试剂是_________,丁中的试剂是_________。
A.饱和碳酸氢钠溶液 B.饱和食盐水
C.浓硫酸 D.饱和碳酸钠溶液
(3)戊在实验中的作用是______________________________________________________
____________________________________________________________________。
(4)若己中盛有足量氢氧化钡,实验后己中共生成1.773 g沉淀,则该实验中CN-被处理的百分率为_________ (Ba的相对原子质量为137)。
(5)若己中盛有的氢氧化钡溶液为10 mL,要使CN-完全被氧化,氢氧化钡的物质的量浓度最低为_________ (保留1位小数)。
(6)上述实验中造成戊中碳酸钡质量测定值偏小的可能原因有(写出两点即可) ____________
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
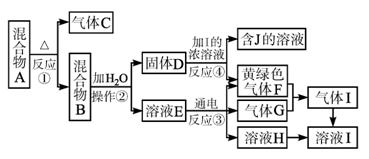
图1-5-22
(1)在实验室中,收集气体C可选择如图图1-5-23甲装置中的_______ (填选项字母)。

图甲 图乙
图1-5-23
(2)操作②的名称是_______,在操作②中所使用的玻璃仪器的名称是_______。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的操作方法是____________________________。
(3)写出下列反应的化学方程式或离子方程式:
反应①______________;反应③______________;反应④______________。
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它通过如上面图乙所示的装置,其中瓶Ⅰ中盛放的是_______,瓶Ⅱ中盛放的是_______。
(5)实验中多余的气体F必须吸收,以免污染空气。图1-5-24是实验室用NaOH吸收气体F的装置,为防止产生倒吸现象,合理的装置是_______ (填序号)。
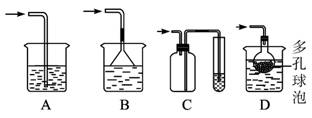
图1-5-24
查看答案和解析>>
科目: 来源: 题型:
甲:卤代烃![]() 溶液
溶液![]()
乙:卤代烃![]()
丙:卤代烃![]() 溶液
溶液![]() 溶液
溶液![]()
结果只有两人观察到产生沉淀。
回答:
(1)观察到沉淀,并能得出正确结论的是_______同学;
(2)观察到沉淀,但不能得出正确结论的是______同学,理由是_________________________。(若认为均可得出正确结论,此小题可不答)
(3)另一位同学没观察到产生沉淀,原因是_________________________________________
____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
请完成下列各题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是__________________________________________。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:_________________________________________________________________。
(3)实验步骤⑥的目的是____________________________________________________。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号) ____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
查看答案和解析>>
科目: 来源: 题型:
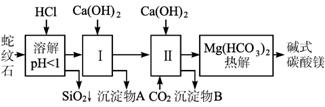
图1-5-21
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是__________________.
(2)进行1操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见下表)
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后________________________ (依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________________ (填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3、bMg(OH)2、cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解
③________________________________________________________________
④________________________________________________________________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:
a=________ b=________ c=________
查看答案和解析>>
科目: 来源: 题型:
(1)有关干电池的基本构造和工作原理。干电池工作时负极上的电极反应式为______,MnO2的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是__________________。
(2)锌皮和碳棒的回收。用钳子和剪刀剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷洗干净,将电池的黑色粉末移入小烧杯中。
(3)氯化铵提纯。
如何从黑色粉末中提取NH4Cl晶体的混合物?写出简要的实验步骤(填操作名称)________。
(4)最后剩余黑色残渣的主要成分是MnO2,还有炭黑和有机物。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外还有____________________________________。
查看答案和解析>>
科目: 来源: 题型:
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量。
(1)方案一是否可行?,_________理由是_______________________________________。
(2)假设测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=_________mol,则说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=_________mol,则说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=_________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比1∶5配制1 000 mL KBrO3KBr溶液,该溶液在酸性条件下完全反应可生成0.5 mol Br2。取反应后的溶液10 mL,加入足量乙醛溶液使其褪色,然后将所得溶液稀释为100 mL,准确量取其中的10 mL,加入过量AgNO3溶液,过滤、洗涤、干燥后称量得到固体0.188 g。若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为_________。
(4)写出上述测定过程中三个反应的离子方程式。
①KBrO3与KBr在酸性条件下的反应:_____________________________________________;
②溴水与乙醛反应:_____________________________________________________________;
③测定Br-含量的反应:__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com