
科目: 来源: 题型:
A.136 B.50 C.86 D.222
查看答案和解析>>
科目: 来源: 题型:
(1)若V1=V2,两溶液恰好完全反应,则c=____________。
(2)若两溶液恰好完全反应,当各离子的物质的量浓度由大到小的顺序为_________时,HA为弱酸,此时溶液呈__________(填“酸”“中”或“碱”)性,并用离子方程式表示溶液显该性质的原因__________。
(3)若HA为弱酸且两溶液物质的量浓度相等,混合溶液中c(Na+)=c(A-)时,V1__________V2(填“>”“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
A.通常所说的三大合成材料包括塑料、合成纤维和合成橡胶
B.加碘食盐中的碘元素以化合态的形式存在
C.高温结构陶瓷、光导纤维均为新型无机非金属材料
D.糖、油脂、蛋白质均为有机高分子化合物
查看答案和解析>>
科目: 来源: 题型:
A.还原产物为![]()
B.氧化剂与还原剂的物质的量之比为8:1
C.若有1 mol ![]() 参与反应,则有3 mol H2O生成
参与反应,则有3 mol H2O生成
D.若把该反应设计为原电池,则负极反应为Fe2+-e-====Fe3+
查看答案和解析>>
科目: 来源: 题型:
A.直径介于1 nm—100 nm之间的微粒称为胶体
B.电泳现象可证明胶体属电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
查看答案和解析>>
科目: 来源: 题型:
A.H与D,16O与18O互为同位素,H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1,电子总数为38的化合物,是含有共价键的离子型化合物
查看答案和解析>>
科目: 来源: 题型:
A.同系物 B.同分异构体 C.同素异形体 D.同位素
查看答案和解析>>
科目: 来源: 题型:
![]()
![]()
图2-3-4
(1)写出电解饱和食盐水的化学方程式________________________________________。
(2)已知工艺条件下食盐的溶解度为36.5 g,则该温度下饱和食盐水溶质的质量分数为__________。
(3)设每台电解槽平均每天消耗2.3×104 mol食盐,电解生成的氯气与氢气按体积比1∶1.15通入合成炉,不考虑各阶段的物料损耗,理论上可生产36.5%的盐酸__________t。
(4)氯气与氢气以1∶a(a>1)通入合成炉,设该厂每天消耗食盐c t,不考虑各阶段的物料损耗,则每天生产36.5%的盐酸__________b t。b=__________t。
查看答案和解析>>
科目: 来源: 题型:
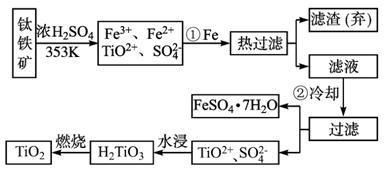
图2-3-3
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第_________族。
(2)步骤①加Fe的目的是:_____________________________________________;
步骤②冷却的目的是:________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_________;考虑成本和废物综合利用因素,废液中应加入_________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
![]()
已知:①C(s)+O2(g)====CO2(g); ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)====2CO2(g); ΔH=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)====TiCl4(s)+O2(g); ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)====TiCl4(s)+2CO(g)的ΔH=_________。
反应TiCl4+2Mg====2MgCl2+Ti在Ar气氛中进行的理由是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com