
科目: 来源: 题型:
A.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
B.制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
C.给试管中的液体加热时不时移动试管或加入碎瓷片,以免暴沸伤人
D.配制浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边加入浓硫酸
查看答案和解析>>
科目: 来源: 题型:
( )
A.质子数c>b B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
查看答案和解析>>
科目: 来源: 题型:
物质 | A | B | CO | H2 |
燃烧热/kJ·mol-1 | 720 | 5 520 | 280 | 286 |

A、B按不同比例混合的燃料91.2 g,在足量的氧气中燃烧时,放出的热量Q与B的物质的量分数x的关系如上图。
(1)A、B的相对分子质量为A___________,B___________。
(2)等物质的量的A、B混合的燃料73 g,在160 L O2中完全燃烧,反应后气体通过浓硫酸后,得到104 L气体,通过碱石灰吸收后剩余3.2 L(气体体积均在标准状况下测定)。由此可推得:
A分子式为___________,B分子式为___________。
(3)1 mol等物质的量的A、B混合的燃料,在一定量的氧气中燃烧,放出热量2 980 kJ,则反应中生成CO___________ mol。
查看答案和解析>>
科目: 来源: 题型:
A.Na2O2、NH4Cl、NaCl、Na2SO4 B.Na2CO3、BaCl2、K2S、盐酸
C.KHCO3、Ca(OH)2、MgCl2、硫酸 D.FeO、AlCl3、Na2SiO3、硝酸
查看答案和解析>>
科目: 来源: 题型:
在量热计中(如下图)将100 mL 0.55 mol·L-1的CH3COOH溶液与100 mL 0.50 mol·L-1NaOH溶液混合,温度从298.0 K升高到300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
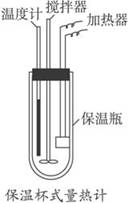
(1)试求CH3COOH的中和热ΔH。
(2)CH3COOH的中和热的文献值为-56.1 kJ·mol-1,你认为(1)中测得的实验值偏差可能的原因是_____________________________________________________________________。
(3)实验中NaOH过量的目的是______________________________________________。
(4)你认为CH3COOH的中和热与HCl的中和热数值相比,_______较大,其原因是____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.-Y kJ·mol-1 B.-(10X-Y)kJ·mol-1
C.-(5X-0.5Y) kJ·mol-1 D.+(10X-Y) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
A.该星球表面温度很高 B.该星球表面温度很低
C.该反应为放热反应 D.高温下稳定性CH2CHOH>CH3CHO
查看答案和解析>>
科目: 来源: 题型:
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列叙述正确的是( )
A.由于Si-C的键能大于Si-Si的键能,所以SiC的熔点高于晶体硅的熔点
B.由于Si-O的键能大于Si-Cl的键能,所以SiO2的熔点低于晶体SiCl4的熔点
C.SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(4×176 kJ·mol-1-4×431 kJ·mol-1)
Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(4×176 kJ·mol-1-4×431 kJ·mol-1)
D.SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(2×176 kJ·mol-1-4×431 kJ·mol-1)
Si(s)+4HCl(g)的反应热计算式为:ΔH=(4×460 kJ·mol-1+2×436 kJ·mol-1)-(2×176 kJ·mol-1-4×431 kJ·mol-1)
查看答案和解析>>
科目: 来源: 题型:
A.A中吸热92.4 kJ B.A中热量变化值大于B中的2倍
C.B中放热46.2 kJ D.A中热量变化值等于B中的2倍
查看答案和解析>>
科目: 来源: 题型:
A.80% B.40% C.60% D.20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com