
科目: 来源: 题型:
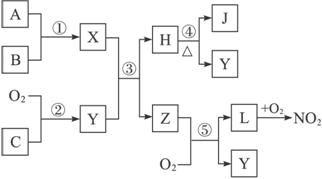
(1)用化学式表示化合物L:_____________,单质C:_____________。
(2)物质Z的分子空间结构是_____________。
(3)反应①的化学方程式为_____________________________________________。
(4)反应⑤的化学方程式为_____________________________________________。
(5)在常温下用气体密度测定NO2的相对分子质量,实验值比理论值偏(填“高”或“低”),其原因是____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.(a+b)×![]() ) mol C.(a+b)mol D.(V·c
) mol C.(a+b)mol D.(V·c
查看答案和解析>>
科目: 来源: 题型:
A.1 mol AlCl3中含有的离子数为4NA
B
C.1 mol CCl4分子中共价键总数为4NA
D.
查看答案和解析>>
科目: 来源: 题型:

请完成下列问题:
(1)单质C和H的化学式分别是____________、____________。
(2)写出由I生成J的离子方程式:___________________________________________。
(3)写出由F生成G的离子方程式:___________________________________________。
(4)若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为____________。
(5)若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A,恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
查看答案和解析>>
科目: 来源: 题型:
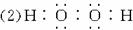
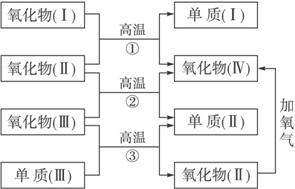
(1)根据上图中的信息,B、C、D、X氧化性从强到弱的顺序是________________________。
(用对应物质的化学式表示)
(2)B的电子式为________________________ 。
(3)写出反应②的化学方程式______________________________________________。
(4)写出反应①⑥的离子方程式:
①______________________________________________________________;
⑥______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
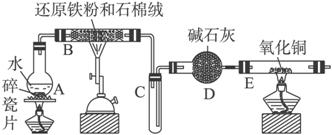
其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)氧化物(Ⅰ)的化学式(分子式)是_________。氧化物(Ⅱ)的化学式(分子式)是_________。
(2)反应①的化学方程式是_______________________________________________。
反应②的化学方程式是____________________________________________________。
反应③的化学方程式是____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)装置B中发生反应的化学方程式是_______________________________________。
(2)装置E中的现象是_____________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:__________________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液![]() FeCl3溶液
FeCl3溶液![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤中通入Cl2的作用是_________________。
②步骤从稀溶液中得到FeCl3·6H2O晶体的主要操作包括:______________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)__________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
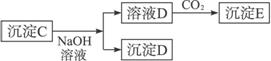
根据实验结果,完成下列问题:
(1)判定待测液中有无Ba2+、Ca2+,并写出理由:____________________________________。
(2)写出沉淀D的化学式_____________________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:________________________________。
查看答案和解析>>
科目: 来源: 题型:
甲 | 向50.00 mL A中加入足量的AgNO3溶液,析出沉淀43.05 g |
乙 | 向50.00 mL A中试探性地加入0.70 g铁粉,结果全部溶解未见固体析出 |
丙 | 向50.00 mL A中加入20.00 mL稀硝酸,产生0.224 L NO(标准状况) |
结合三位同学实验提供的信息,请完成下列问题:
(1)该厂所使用的FeCl3溶液的物质的量浓度(反应前后溶液的体积变化忽略不计)__________。
(2)A中c(Cu2+)的取值范围_______________。
(3)若向乙同学实验后的溶液中加入足量的稀硝酸,结果生成0.56 L NO(标准状况),则A中Cu2+的物质的量浓度为_____________。
查看答案和解析>>
科目: 来源: 题型:
A.电子垃圾应在无污染的条件下回收,使之成为有用的资源
B.将电子垃圾在火上焚烧,熔下其中的金属再回收利用
C.电子垃圾的任意抛弃会严重污染地下水
D.各国的电子垃圾应在本国境内处理,严禁向其他国家输出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com