
科目: 来源: 题型:

(1)设计甲装置是依据了___________(填已学某仪器名称)的原理。甲中装置Ⅱ___________(填“能”或“不能”)用乙装置来代替。
(2)甲中Ⅱ内盛有的液体是___________,该装置可看作是一个___________(填某仪器名称),简述其主要原理。
查看答案和解析>>
科目: 来源: 题型:
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
查看答案和解析>>
科目: 来源: 题型:
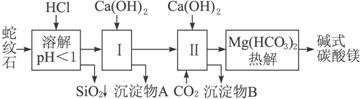
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是___________。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀Ph | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7—8,(有关氢氧化物沉淀的pH见上表)Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解,________沉淀。
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后_________________________(依次填写实验操作名称)。
(4)物质循环使用,能节约资源。上述实验中,可以循环使用的物质是________(填写物质化学式)。
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量 ②高温分解 ③___________ ④______________ ⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=________,b=________,c=________。
查看答案和解析>>
科目: 来源: 题型:
(1)制备氧化铜
工业CuSO4![]()
![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O
CuSO4·5H2O![]() ……
……![]() CuO
CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是____________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是___________________________________________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是____________________________,过滤,水浴加热烘干。水浴加热的特点是_______________________________________________。
(2)探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡。结论是_________________________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.胶体产生丁达尔效应是由胶粒的大小决定的
B.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
C.分子晶体溶于水时,一定不破坏共价键
D.配制FeCl3溶液时,向溶液中加入少量Fe粉和稀盐酸
查看答案和解析>>
科目: 来源: 题型:
(1)在下表中填出A和B可能的化学式。(不一定填满)
| A的化学式 | B的化学式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
(2)当氧和碳的质量比等于2时,试确定A和B的可能组成以及A与B的物质的量之比。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

(1)甲同学取合金样品14.0 g加入A中,然后将装置A、B相连,并向A中加入13.0 mol·L-1的硝酸25.0 mL充分反应后测得生成气体的体积为2.24 L(标准状况下),及反应后容器A中溶液H+浓度为1.0 mol·L-1(假设反应后溶液体积不变)。利用以上数据,你认为甲同学能得到合金中铜的质量分数吗?如果能,请写出计算过程及结果;如果不能,请简述理由。
(2)乙同学将装置A、C相连,向A中加入w g合金样品和足量浓硝酸充分反应,将生成的气体简单作了吸收处理后,便向反应后的A溶液中加入一种常见试剂,充分反应后,再经过简单的实验操作就达到了目的。请你简述他的实验思路。
(3)丙同学将装置A、D相连,向A中加入一定质量的合金样品和足量浓硝酸,充分反应后用排水集气法测定了生成气体的体积,也达到了实验目的。
①D中发生反应的化学方程式:______________________________________________。
②假设已知合金中Cu、Ag的总物质的量为a mol,水洗后气体的体积是b L(标准状况下),则合金中Cu的物质的量是___________。(结果不必简化)
查看答案和解析>>
科目: 来源: 题型:

(1)[实验一]所用试剂:甲___________、乙___________、丙___________。
丙中现象______________________________________________________________。
实验结论______________________________________________________________。
(2)[实验二]所用试剂:甲___________、乙___________、丙___________。
丙中现象_____________________________________________________________。
实验结论______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
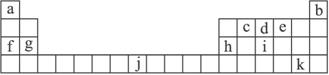
(1)上述所列元素的原子中,最外电子层只有两个电子的有(填元素符号)___________。(2)所列元素形成的单质中,有一种通常情况下为液态,该单质的化学式是_______________;d的氢化物的沸点比i的氢化物_________________(填“高”或“低”),主要原因是_____________________________________________。
(3)水解反应是一类重要的化学反应,中学已经学习过许多的水解反应。请用所列11种元素组成能发生水解反应的物质来回答问题:
①写出一种由三种元素组成的无机物__________。
②写出两种由三种元素组成且所属类别不同的有机物___________和___________。
(4)将等物质的量的f、h的单质投入足量水中,向反应后的溶液中逐滴加入浓度为1 mol·L-1的盐酸溶液,至100 mL时沉淀刚好达到最大值,则投入h的物质的量为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com