
科目: 来源: 题型:
(1)若要求出重水的质量分数y,至少需要上述m、x、m1、m2等4个数据中的____________个。这些数据共有几组,在下列橫线上分别列出(有多少填多少)。
_____________________________________________________________________。
(2)从(1)中空格所填的数据中任取一组含m1的数据,计算已被电解的水中D2O的质量分数y=_______________。
查看答案和解析>>
科目: 来源: 题型:
Mg(OH)2在水中存在如下溶解平衡:Mg(OH)2(s) ![]() Mg2++2OH-,NH4Cl水解使溶液显酸性,其中H+与Mg(OH)2电离出来的OH-结合生成难电离的水,使Mg(OH)2的溶解平衡向右移动而溶解。为了检验其解释是否正确,学生乙用CH3COONH4(其溶液显中性)代替NH4Cl做实验,发现Mg(OH)2也溶解了。
Mg2++2OH-,NH4Cl水解使溶液显酸性,其中H+与Mg(OH)2电离出来的OH-结合生成难电离的水,使Mg(OH)2的溶解平衡向右移动而溶解。为了检验其解释是否正确,学生乙用CH3COONH4(其溶液显中性)代替NH4Cl做实验,发现Mg(OH)2也溶解了。
(1)学生甲的解释是____________(填“合理”或“不合理”),请说明理由___________________。
(2)请阐述你对Mg(OH)2溶于NH4Cl溶液的解释:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
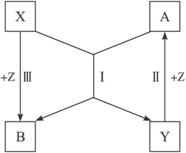
(1)如果X、Y的组成元素不同族时,按下列条件写出(Ⅰ)的化学方程式:
①已知B是水______________________________________________________________。
②已知A、B都是氧化物_____________________________________________________。
(2)如果X、Y的组成元素不同族时,按下列要求写出X、Y、Z的化学式(任写一组):
①若X的组成元素是地壳中含量最多的金属元素,则Y为____________,Z为____________。
②若Y的组成元素是自然界中形成化合物种类最多的元素,则X为____________,Z为____________________。
查看答案和解析>>
科目: 来源: 题型:
R—X+ R′—X+2Na![]() R—R′+2NaX(反应式中的R和R′可以相同,也可以不相同)
R—R′+2NaX(反应式中的R和R′可以相同,也可以不相同)
试以苯、乙炔、Br2、HBr、H2、钠为主要原料制备![]() ,
,
写出各步反应的化学方程式。
查看答案和解析>>
科目: 来源: 题型:
(1)从开始反应到平衡状态,生成C的平均反应速率为____________________。
(2)x=____________。
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,化学平衡(填字母)____________________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再通入a mol C,在t ℃达到新的平衡,此时B的物质的量n(B) =____________mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的量n(A)、n(B)、n(C)之间应该满足的关系为________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出以上反应的离子方程式________________________________。
(2)你认为出现以上现象的可能原因是:
假设(1)____________________;假设(2)____________________。
(3)请设计实验对以上的假设进行验证:
①________________________________;②________________________________________。
(4)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施是:
①____________________________________________________;
②____________________________________________________;
③____________________________________________________ ;
④____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请完成下列问题:
(1)浓硫酸的作用是____________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式____________________。
(2)球形干燥管C的作用是________________________________________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)________________________________;反应结束后D中的现象是___________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目: 来源: 题型:
A.该灰黑色粉末作抗氧剂 B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉 D.小袋中原来装有Fe2O3
查看答案和解析>>
科目: 来源: 题型:
A.该反应的氧化剂只有Cu2O B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物,又是还原产物 D.每生成19.2 g Cu,反应中转移0.6 mol电子
查看答案和解析>>
科目: 来源: 题型:
A.NaOH溶液[Ba(OH)2溶液] B.FeSO4溶液(KSCN溶液)
C.KI溶液(淀粉溶液) D.Na2SO3溶液(BaCl2溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com