
科目: 来源: 题型:
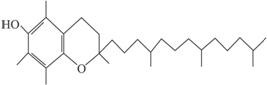
A.维生素E的化学式为:C29H50O2
B.维生素E的还原性主要是酚羟基表现出来,若被酯化后就不具有抗氧化活性
C.维生素E易溶于水和乙醇、苯等有机溶剂
D.维生素E虽含有酚羟基,但不能与溴水反应
查看答案和解析>>
科目: 来源: 题型:
(1)写出放电时正负极的电极反应式:
正极反应式:_____________________;负极反应式:__________________________。
(2)用该电池作电源进行电解M(NO3)m溶液时,若此电池工作一段时间后消耗46 g Na,电解池的某一极增重m g,则金属M的相对原子质量为:_______________(用m、x表示)。
(3)用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时,若此电池工作一段时间后消耗23 g Na。则阳极产生气体的体积为:___________L(标准状况下);电解后溶液加水稀释至2 L,溶液的pH为:_____________。
查看答案和解析>>
科目: 来源: 题型:
![]()
葡萄糖发酵的方程式:C6H12O6![]() 2C2H5OH+2CO2↑,以戊烷(C5H12)表示汽油。
2C2H5OH+2CO2↑,以戊烷(C5H12)表示汽油。
某化学兴趣小组取一定量的乙醇汽油加热到使其汽化,测得蒸气的密度是2.4 g·L-1,测得此时的气体摩尔体积V0=29.46 L·mol-1。
(1)汽化后的乙醇汽油中乙醇所占的体积分数是________________。
(2)现在欲加工得到14.14吨乙醇汽油,理论上需要纤维素________________克。
查看答案和解析>>
科目: 来源: 题型:
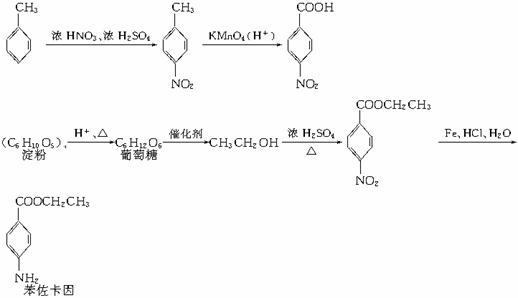 ?
?已知:①苯环上的取代有如下定位规律:当苯环上的碳原子上连有甲基时,可在其邻位或对位上引入基团;当苯环上的碳原子连有羧基时,可在其间位上引入基团。
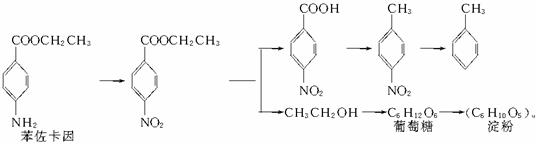
④—NH2具有较强的还原性和弱碱性。
请以甲苯、淀粉为主要原料合成苯佐卡因,用反应流程图表示出最合理的合成方案(注明反应条件)。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
![]()
查看答案和解析>>
科目: 来源: 题型:
(1)A的分子式为________________。
(2)C的结构简式为________________。
(3)在B的同分异构体中,有一类属于酯,且苯环上的一氯取代物只有2种,则其可能的结构简式有(只需写出其中任意四种)_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:

请完成下列问题:
(1)组成合金A的4种单质为(写出化学式):___________、___________、___________、___________。
(2)写出由黑色固体H生成气体F的化学反应方程式:_______________________________。
(3)写出合金A中有关成分与过量烧碱溶液反应的离子方程式:________________________。
(4)写出向无色溶液C中通入过量气体F生成白色沉淀D的有关反应的离子方程式:_________________________________,_________________________________。
查看答案和解析>>
科目: 来源: 题型:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,试完成下列有关问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的x值变化的规律是:____________________________________________;
x值与原子半径的关系是:________________________________________________________。
(2)预测周期表中电负性最大的元素应为_______(填元素符号);估计钙元素的电负性的取值范围:__________<x<__________。
(3)预测周期表中,x值最小的元素位于第_________周期_________族。(放射性元素除外)
(4)经验规律告诉我们:当成键的两原子相应元素的x差值Δx>1.7时,一般形成的键为离子键,当Δx<1.7时,一般形成的键为共价键。试推断AlBr3中化学键的类型为__________,其理由是__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
下图为某实验者设计的验证银圆完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0 ℃时,几乎只有无色的N2O4晶体存在。
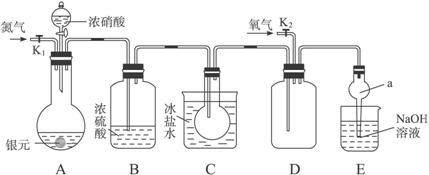
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是______________________。
(2)若装置中缺B,其后果是____________________________________________________。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是____________________________。
(4)C装置的作用是______________________;E中a仪器所起的作用是________________。
(5)已知该银圆的质量为25 g,加入75 mL 12 mol·L-1的浓硝酸。实验结束后,A中烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75 mL。
①参加反应的硝酸的物质的量是_________________。
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是__________________________。
查看答案和解析>>
科目: 来源: 题型:
①用pH试纸鉴别浓硫酸与浓硝酸
②用硝酸银溶液区分二氧化氮和溴蒸气
③酒精灯被碰倒洒出酒精着火时,迅速用湿抹布扑盖
④用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
⑤温度计被摔坏导致水银散落到地面上,应立即用水冲洗水银
⑥称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
⑦为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
⑧检验氯代烃中的氯元素时,可先加氢氧化钠溶液并加热,再加入硝酸银溶液来进行检验
(2)实验室中利用电石和水反应制取一定量乙炔来进行其性质实验(通入溴水、酸性KMnO4溶液),最后点燃(如下图)。完成下列问题:

①制取乙炔的化学方程式为:__________________________________________。
②实验前,应检查气体发生装置(如上图虚线框内装置)的气密性。某同学用双手捂住烧瓶,把导气管伸入水面下,但无任何气泡冒出,则出现此现象的原因可能是___________(填代号)。
A.没有关闭分液漏斗的活塞
B.橡皮塞上的孔与导管不匹配或橡皮塞与分液漏斗不匹配
C.导管伸入水面下太深
D.烧瓶容积较大
③实验室用上图方法点燃乙炔,由于乙炔在空气中燃烧会产生浓烈的黑烟,所以在实验时点燃后要迅速熄灭火焰。试用一种简单的、安全的操作方法熄灭火焰:_________________________________。
查看答案和解析>>
科目: 来源: 题型:
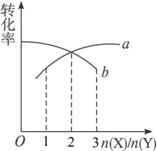
A.图中曲线a为X,n=1 B.图中曲线b为X,n=1
C.图中曲线a为X,n=2 D.图中曲线b为X,n=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com