
科目: 来源: 题型:
A.H2O分子内含有氢键,所以水的熔、沸点比H2S高
B.CO2分子内含有极性键,所以CO2分子为极性分子
C.淀粉分子直径在1 nm—100 nm之间,所以淀粉水溶液是胶体
D.鸡蛋白受热后变性且不溶于水,所以不能在肠胃中水解成氨基酸
查看答案和解析>>
科目: 来源: 题型:
(1)求该城市用煤的含硫量。
(2)若该城市平均每天烧煤8万吨,其中80%的硫转化为SO2进入空气中,设这些SO2中有20%未能扩散而随着8×108 m3的雨水降落地面,计算此次酸雨的最终pH。
查看答案和解析>>
科目: 来源: 题型:
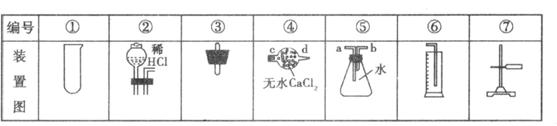
请回答下列问题:
实验一:测定Na2CO3样品中的NaHCO3分解放出的二氧化碳的体积。
(1)连接装置的正确顺序是:_________接_________接_________接_________。
(2)完成实验一尚缺的仪器是:___________________________。
(3)气体应从装置⑤的_________端进入。
实验二:测定经实验一后的固体物质与盐酸反应放出二氧化碳的体积。
(4)应将实验一的装置作哪些调整?___________________________。
(5)当实验一测得产生的二氧化碳的体积折算成标准状态下时为a L,当实验二测得产生的二氧化碳的体积折算成标准状态下时为b L。则该样品中碳酸钠纯度的实验值为:___________________________。
(6)测得的实验值与理论值比较,实验值的结果会_________(填“偏大”“偏小” 或“相等”)。
(7)若要使实验值更接近理论值,该实验应如何改进?(用文字简要说明)
__________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
下面是8个化合物的转化关系图:
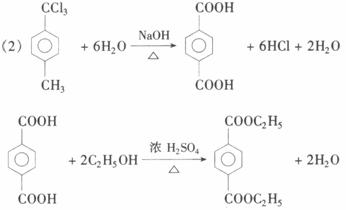
其中化合物⑥和⑧互为同分异构体,试回答下列问题:
(1)化合物①的结构简式为__________________,它跟Cl2发生反应的条件A________,生成化合物⑥的反应类型为__________________。
(2)写出下列反应的化学方程式:
化合物③水解生成化合物④:___________________________。
生成化合物⑧:____________________________________。
(3)生成化合物⑦的条件B是_________,工业上采用条件B是为了______________________。
查看答案和解析>>
科目: 来源: 题型:
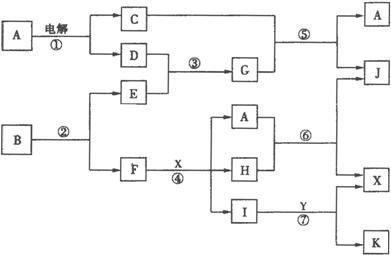
请按要求填空:
(1)写出实验室制取气体G的化学反应方程式:
___________________________________________________________________
(2)写出反应⑤的化学方程式:
___________________________________________________________________
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为
___________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是:
_________________________________________________________________
(2)保持上述温度和压强不变,若向容器中只充入2 mol SO3并加入固体催化剂。
则平衡时SO2的体积分数是_________,容器的体积为_________L。
(3)温度仍为537℃,容器体积保持200 L不变(恒容)。充入a mol SO2、b mol O2,并加入固体催化剂,反应达平衡时,SO3的体积分数仍为91%,体系压强为1.01×105Pa。若a:b=2:1,则a=__________mol。
查看答案和解析>>
科目: 来源: 题型:
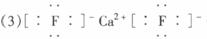
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是____________(选择“A”或“D”);A和B的离子中,半径较小的是_________(填离子符号)。
(2)元素C在元素周期表中的位置是__________________。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如上图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)均位于小正方体中心。该化合物的电子式为__________________。
查看答案和解析>>
科目: 来源: 题型:
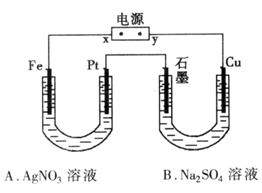
①电源x极为____________极
②B池中阳极电极反应试是_______________________________。
③标况时,如果A中共收集到0.56L气体,则A池中的pH为_______________。
查看答案和解析>>
科目: 来源: 题型:
A.0.75 mol/L B.1.5 mol/L
C.2 mol/L D.3 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com