
科目: 来源: 题型:
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.275 | 0.605 | 0.715 |
气体体积/mL | 392 | 784 | 784 |
请回答下列问题:
(1)甲组实验中,NaOH溶液_________(选填“过量”“适量”或“不足”)。
(2)合金中硅铝的物质的量之比为_________。
(3)计算氢氧化钠溶液的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
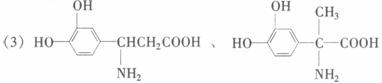 (相对分子质量为197)。
(相对分子质量为197)。
(1)L-多巴分子中含有的官能团(羟基除外)的名称为_________。
(2)L-多巴不可能发生的反应有_________(选填序号)。
①加成反应 ②取代反应 ③酯化反应 ④加聚反应 ⑤缩聚反应 ⑥消去反应 ⑦与强酸反应 ⑧水解反应
(3)写出符合下列条件的L-多巴同分异构体的结构简式。
①与L-多巴中苯环上的取代基位置相同;②与L-多巴物质类别相同。
_____________________________________________________________________。
(4)写出L-多巴与适量NaHCO3溶液反应的化学方程式:
_____________________________________________________________________。
(5)在浓硫酸存在并加热下,L-多巴分子相互作用可生成一种相对分子质量为358的含N六元环状化合物,写出此反应的化学方程式:
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
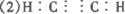
(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液。图示转化中的离子方程式为___________________________。
(2)若C是一种四原子分子,分子中四个原子在一条直线上;A与B的溶液反应时只生成气体C、CaCO3和H2O,则C的电子式为_________,B的化学式为__________________。
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离子;D不溶于稀硝酸。
①A的化学式为___________________________。
②B的溶液中各离子浓度由大到小的顺序为__________________。
查看答案和解析>>
科目: 来源: 题型:
(1)根据以上叙述判断,所涉及的三种酸中,属于弱酸的是_________,判断理由是_________
_________________________________________________________________。
(2)在某反应体系中,只有高碘酸、硫酸锰、硫酸、碘酸、高锰酸和水,且反应过程中高碘酸作氧化剂,试写出该体系中发生反应的化学方程式___________________________;若该反应恰好反应完全且有0.1 mol电子发生转移,反应后溶液体积为100 mL,则所得溶液中c(H+)=__________________。
查看答案和解析>>
科目: 来源: 题型:
(1)已知在101 kPa时,29 g丁烷气体在氧气中完全燃烧生成液态水和二氧化碳气体,放出QkJ的热量,试写出丁烷完全燃烧的热化学方程式___________________________。
(2)以丁烷为燃料、空气为氧化剂,选用具有催化作用和导电性能的稀土金属材料为电极,用熔融的K2CO3(其中不含O2-和![]() )为电解质组成燃料电池。
)为电解质组成燃料电池。
负极反应:2C4H10+26![]() -52e-====34CO2+10H2O
-52e-====34CO2+10H2O
正极反应:____________________________________。
为了使燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是_________,它来自___________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
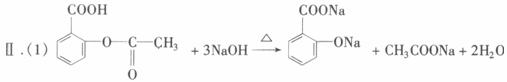
已知:①阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);②酚类物质与FeCl3溶液在弱酸性条件下能发生显色反应。
某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
Ⅰ.验证乙酰水杨酸中具有羧基和酯的结构(—COOR)。
①将一片阿司匹林研碎后溶于水,静置,各取清液2 mL于两支洁净的试管中;
②向一支试管中加入_________,若观察到__________________,即证明乙酰水杨酸中有羧基;
③向另一支试管中加入适量NaOH溶液,加热几分钟,冷却后逐滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为_________色,即证明乙酰水杨酸中具有酯的结构。
回答下列问题:
(1)将上述三处空白补充完整。
(2)实验中滴加稀H2SO4的作用是__________________。
Ⅱ.该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量:
①称取阿司匹林样品m g;
②将样品研碎,溶于V1 mL a mol·L-1 NaOH溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴指示剂,用浓度为b mol·L-1的标准盐酸返滴未反应的NaOH,消耗盐酸的体积为V2 mL。
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热时发生反应的化学方程式为__________________;其中,加热的目的是__________________________________________。
(2)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是_____________________
____________________________________________________________________。
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为_____________
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.取KOH、Ca(OH)2、Ba(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色
C.向滴有酚酞的20.0mL0.10mol·L-1 NaOH溶液中,逐滴加入25.0 mL 0.10mol·L-1的盐酸,观察溶液颜色变化
D.向滴有酚酞的25.0 mL0.10mol·L-1盐酸中,逐滴加入20.0mL0.10mol·L-1的NaOH溶液,观察溶液颜色变化
查看答案和解析>>
科目: 来源: 题型:
A.相同温度下,1 mol·L-1醋酸溶液与0.5 mol·L-1醋酸溶液中,c(H+)之比是2:1
B.向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)=c(CH3COO-)
C.pH=3的盐酸和醋酸加水使溶液体积分别扩大100倍,pH仍相同
D.0.1 mol·L-1 NH4Cl溶液中c(![]() )+c(H+)=c(Cl-)
)+c(H+)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
A.K3C60中既有离子键,又有极性键
B.1 mol K3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下能导电
D.该物质的化学式可写为KC20
查看答案和解析>>
科目: 来源: 题型:
A.BrCH2CH2Br B.ClCH2CH2I
C.BrCH2CH2I D.BrCH2CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com