
科目: 来源: 题型:
A.在标准状况下,11.2 LSO3所含原子数目为2 NA
B.0.1 mol N![]() 离子中所含的电子数为3.5 NA
离子中所含的电子数为3.5 NA
C.5.6gFe与足量的氯气反应时失去的电子数目为0.2 NA
D.1 L0.3mol/L氯化钡溶液中含氯离子的数目为0.6 NA
查看答案和解析>>
科目: 来源: 题型:
A.④>①>③>② B.①>④>③>②
C.①=④>③=② D.①=④>③>②
查看答案和解析>>
科目: 来源: 题型:
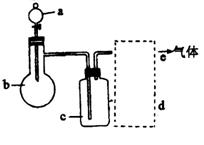
(1)在下表中填入最合适的试剂:
要制取的气体 | a | B | c | d |
C2H2 |
| 电石 | NaOH溶液 | 碱石灰 |
Cl2 | 浓盐酸 | MnO2 |
| 浓H2SO4 |
NO | 稀硝酸 | ①CaCO3②铜屑 |
| 固体P2O5 |
CO |
|
| NaOH溶液 | 浓H2SO4 |
(2)制取C2H2时,仪器C中NaOH溶液的作用是________________。
(3)制取Cl2时,必须处理多余的Cl2,其简易的处理方法是____________,写出上述方法对应的离子方程式___________。
(4)制取NO时,加入CaCO3的作用是____________。
(5)请在给出的实验装置基础上,进行改进,以证明浓硫酸使甲酸脱水时,既制得了CO,同时又产生了少量CO2,简述一种合理的实验改进方法:
答:______________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)若已知E溶于NaOH溶液,则B是________元素,A元素位于元素周期表中________族________周期,C元素的原子结构示意图为________。
(2)若已知E不能溶于NaOH溶液,则A的元素符号为________,F的电子式为________________。
(3)若在上述(1)中得到的溶液I呈酸性,请用有关离子方程式解释其呈酸性的原因________________________。
(4)若在常温下把上述(2)中所得G气体压缩到一个容积固定的密闭容器中,加热至60℃时发现容器内压强迅速下降,当压强降至略小于原压强的![]() 时(压强均在同温下测定)即不再改变,此时测得其中一种产物的相对分子质量为44,请写出容器内发生的分解反应的化学方程式________________。
时(压强均在同温下测定)即不再改变,此时测得其中一种产物的相对分子质量为44,请写出容器内发生的分解反应的化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
(1)X分子中含有官能团的名称:________________。
(2)X分子的结构简式为:______________________。
(3)X分子在一定条件下可发生多种化学反应(如图):
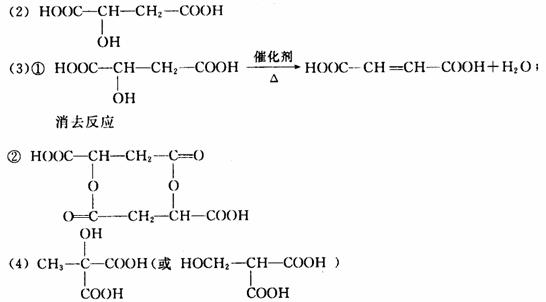
①写出反应①的化学方程式:________________;其反应类型为:________________;
②写出Z的结构简式:___________________。
(4)X的同分异构体有多种,试写出与X同类别的一种同分异构体的结构简式________________。
查看答案和解析>>
科目: 来源: 题型:
①NaCI溶液 ②稀H2SO4 ③CuSO4溶液 ④Na2CO3溶液 ⑤蒸馏水 ⑥苯 ⑦CCl4
某同学用电解法制Fe(OH)2,装置如图所示,请回答:
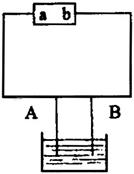
(1)若A极材料为石墨,B极材料为铁,则电源的a极为________极,电解质溶液应选择(填序号)________。
(2)通电后两极和溶液中的反应为:
阳极:________;阴极:________;溶液中:________。
(3)为了使实验效果更好,在通电前通常还应对溶液采取哪两种处理措施。
答:①________________,②________________。
(4)产生白色絮状沉淀后,将电源反接,此时两极可观察到的现象为:A极_______;B极________,并写出电解反应总的离子方程式________________。
查看答案和解析>>
科目: 来源: 题型:
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.2 mol FeSO4发生反应时,共有10 mol电子转移
查看答案和解析>>
科目: 来源: 题型:
A.![]() N2H4(g)+
N2H4(g)+![]() O2 (g)====
O2 (g)====![]() N2 (g)+ H2O (g);ΔH=+267kJ/mol
N2 (g)+ H2O (g);ΔH=+267kJ/mol
B.N2H4(g)+O2 (g)+====N2(g)+2H2O (g);ΔH=-133.5 kJ/mol
C.N2H4(g)+O2 (g)==== N2 (g)+2H2O (g);ΔH=+534 kJ/mol
D.N2H4(g)+O2 (g)==== N2 (g)+2H2O (g);ΔH=-534 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
R1—13CH=13CH—R1+R2—CH=CH—R2![]() 2R1—13CH=CH—R2,该反应是目前工业上制备丙烯最为合理的方法。制备丙烯的两种原料可能是( )
2R1—13CH=CH—R2,该反应是目前工业上制备丙烯最为合理的方法。制备丙烯的两种原料可能是( )
A.CH2=CH2和CH2=CH—CH2CH3 B.CH2=CH2和CH3—CH=CH—CH3
C.CH2=CH2和CH2=CH—CH=CH2 D.CH2=CH2和(CH3)2C=CH2
查看答案和解析>>
科目: 来源: 题型:
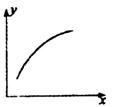
| x | Y |
A. | 再通入A | B的转化率 |
B. | 压强 | A的百分含量 |
C. | 温度 | 混合气体的平均相对分子质量 |
D. | 加入催化剂 | A的质量分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com