
科目: 来源: 题型:
A.R元素和氮元素的气态氢化物的化学式分别为RH3、NH3
B.![]() 中R原子的质子数是15
中R原子的质子数是15
C.R与氮两元素的原子最外层电子数不相同
D.![]() 和硝酸根离子都只能被还原不能被氧化
和硝酸根离子都只能被还原不能被氧化
查看答案和解析>>
科目: 来源: 题型:
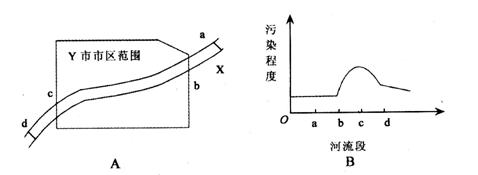
A.造成X河污染的主要污染源最可能分布在bc段
B.工业生活污水、固体废弃物等可能是造成X河污染的污染源
C.cd段污染程度逐渐减小,可能是某些污染物的离子间发生反应生成沉淀所致
D.该城市建造硫酸厂时,综合考虑诸多因素选址在b处最合理
查看答案和解析>>
科目: 来源: 题型:
A.向MgSO4、H2SO4的混合溶液中加入过量的氢氧化钡溶液
B.Fe3O4溶于适量的稀盐酸中
C.向稀盐酸中滴入少量的NaAlO2溶液
D.NaOH溶液与CH3COOH溶液反应后所得到的pH>7的溶液
查看答案和解析>>
科目: 来源: 题型:
A.臭氧有漂白作用,其漂白原理与SO2的漂白原理相同
B.臭氧转化为氧气和氧气转化为臭氧均需要吸收能量
C.和氧气比较,臭氧的氧化性较强,臭氧的能量较高
D.臭氧和氧气互为同素异形体,它们之间的转化是物理变化
查看答案和解析>>
科目: 来源: 题型:
A.同位素:1H2、2H2、3H2 B.分子晶体:I2、SO3、固态氩
C.非电解质:Cl2、BaSO4、C2H5OH D.化合物:重水、双氧水、矿泉水
查看答案和解析>>
科目: 来源: 题型:

(1)A电极是接电源的_______________极;B电极的反应式_______________。
(2)写出电解总反应方程式__________________________。
(3)原溶液溶质的物质的量浓度为________________;电解后溶液的pH为_____________。
(假设电解前后溶液的体积不变)
(4)请你设计实验确定原溶液中可能所含的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤、实验现象和实验结论。
假设①___________________;假设②_____________________。
查看答案和解析>>
科目: 来源: 题型:
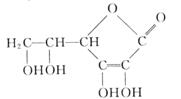
(1)维生素C除在医药工业上有广泛用途外,还在哪里有广泛应用?其中体现了维生素C的什么性质?__________________。
(2)上述合成过程中与A互为同分异构体的有_________(填写字母代号)。
(3)上述反应中,属于加成反应的有_________(填数字序号)。
(4)反应④除生成E外,还有_________生成。
(5)比较D和G的结构可知,G可看成由D通过反应⑤氧化得到,在工业生产中设计④和⑥两步的目的是_________。
(6)写出维生素C的结构简式__________________。
查看答案和解析>>
科目: 来源: 题型:
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ装置来进行实验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O====NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
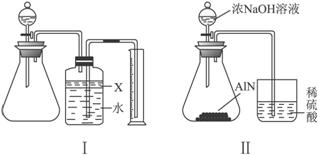
(1)实验有关操作为:
A.往锥形瓶中放入适量的AlN样品 b.从分液漏斗往锥形瓶中加入过量的浓NaOH
c.检验装置的气密性 d.测定收集到水的体积
正确的操作顺序为___________________________。
(2)本实验中检查装置气密性的方法是__________________。
(3)广口瓶中的试剂X应选用_________(填选项的编号)。
A.汽油 B.酒精 C.植物油 D.CCl4
(4)广口瓶内的液体没有装满(上方留有少量空间),实验测得NH3的体积将_________(填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是_________。
(6)若实验中测得样品的质量为wg,氨气的体积为a L(标况下),则样品中AlN的质量分数为_________(AlN的式量为41)。
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中A1N的质量分数。你认为是否可行?_________(填“可行”或“不可行”)。原因是_________,改进的方法为_________(若认为“可行”,此空格不需回答)。
查看答案和解析>>
科目: 来源: 题型:
其中:X、Y为常见双原子气体单质(X为有色气体);B为常见金属单质,质软;E为由两种常见元素(按原子个数1:1)组成的液体;A为黑色化合物。上述各步转化中只写出其中一种生成物,其他生成物没有写出(也有可能反应只有一种生成物)。
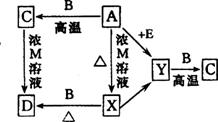
试回答:
(1)写出化学式:X_________,E_________。
(2)写出离子方程式:A→X:_________;C→D:_________。
(3)X+E反应的化学方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
A.该超级原子微粒含有169个价电子
B.镁能和All3作用生成Mg(Al13)2
C.等质量的超级原子Al13和普通铝含有的Al原子的个数比为13:1
D.超级原子Al13能形成(Al13)3分子而不能形成(Al13)2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com