
科目: 来源: 题型:
A.质子数相等,电子数也相等的两种粒子可能是不同的离子?
B.CaF2和Na2O2的化学键和晶体类型均相同?
C.C6H6、SiO2、CO2均为分子晶体?
D. ![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目: 来源: 题型:
(1)B和N反应的离子方程式为 。?
(2)若以M为电极电解A的水溶液时,阳极上的电极反应式为 ,阴极上的电极反应式为 。?

(3)D与G反应生成1.12 L标准状况下的F时,转移的电子数为? ?。?
(4)G与M反应的化学方程式为 。?
(5)I可用于净化水,其原因是(用离子方程式表示) 。?
(6)若以惰性电极电解A的水溶液时,通电一段时间后,阳极上生成448 mL的气体(标准状况),此时溶液的体积为400 mL,则溶液的pH为? ?。?
查看答案和解析>>
科目: 来源: 题型:阅读理解

(1)实验室制取氨气的化学方程式为 ,工业上合成氨采取的下列措施中可用勒夏特列原理解释的是? ?(填字母)?
A.采用较高压强(20 Mpa~50 Mpa)?
B.采用500 ℃的高温?
C.用铁触媒作催化剂?
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2?
(2)适当改变如图所示的装置后,也可用来制取和收集氧气。改变的方法是: 。?
(3)实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置 ? ?(填“能”或“不能”),若选填“能”,请说明理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请用文字说明 ;?
(4)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,某同学根据所学的化学知识认为还有一定量的硫酸剩余。下列药品能够用来证明反应结束后烧瓶中确实有余酸的是?? ??(填字母)。?
A.铁粉 B.氯化钡溶液? C.银粉 D.碳酸氢钠溶液?
(5)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的
是 (填字母)?
A.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量?
B.将装置中产生的气体缓缓通入足量氢氧化钡溶液,反应完全后过滤、洗涤、干操、称量沉淀?
C.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后过滤、洗涤、干燥、称量沉淀?
请对不可行的方案进行分析(可以不填满)
方案序号 | 分析 | 误差(偏高或偏低) |
|
|
|
|
|
|
|
|
|
(6)请再设计其他可行的实验方案来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。??
查看答案和解析>>
科目: 来源: 题型:
(1)一氯胺的空间结构为? ?形,电子式为? ?。?
(2)若把氨基换成乙基,则构成的物质A属于? ?类有机物,A在碱性溶液中能发生水解反应的方程式是 。?
(3)若由A通过反应,最终可以制得乙酸乙酯,反应过程可能涉及到的反应类型有 。(用A、 B…表示)?
①取代反应 ②加成反应 ③氧化反应 ④消去反应 ⑤酯化反应?
A.①⑤ B.①③⑤? C.②④⑤ D.①②④?
Ⅱ已知有机物A~F有如下转化关系?

①A的分子式为C10H20O2。②B分子中有两个甲基。?③D、E互为具有相同官能团的同分异构体。D能与碳酸氢钠溶液反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种。④F可以使溴的四氯化碳溶液褪色,G为高分子化合物。?
(1)B可以发生的反应有? ?(选填序号)。?
①取代反应 ②消去反应 ③加聚反应 ④氧化反应?
(2)D、F分子所含的官能团的名称依次是? ?、? ? 。?
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 。?
(4)写出下列转化的化学方程式?
B+E→A ;?
F→G 。?
查看答案和解析>>
科目: 来源: 题型:阅读理解
(1)A、B、C、D四种元素组成的化合物中既能与盐酸反应,又能与NaOH反应的相对分子质量最小的化合物的结构简式为? ?,A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式? ?,其水溶液的pH? ?7(填“>”“<”或“=”)。
(2)将ACD3的稀溶液和CA3的水溶液混合,不可能出现的结果是(填字母)? ?。?
a.pH<7,且c(H+)>c(CD-3)>c(OH-)>c(CA+4)?
b.pH<7,且c(CD-3)>c(OH-)=c(H+)>c(CA+4)
c.pH>7,且c(CA+4)>c(OH-)>c(CD-3)>c(H+)?
d.pH=7,且c(CA+4)>c(CD-3)>c(H+)>c(OH- )?
(3)A、D、E与氯四种元素中的三种组成化合物X、Y,组成元素原子个数比为1∶1∶1,其水溶液的酸碱性与CA3水溶液的相同;常温下0.1 mol·L-1?的X溶液的pH与0.1 mol·L-1?盐酸的pH之和为14;则X、Y的化学式为X ,Y 。?
(4)常温下,0.01 mol·L-1X的溶液中,水电离产生的OH-的物质的量浓度为? ? mol·L-1;相同pH的X、Y溶液,加水稀释相同倍数后,溶液的pH分别为a1、a2,则a1 a2(填“>”“<”或“=”)。?
(5)“神舟”六号发射时所用火箭推进器中盛有液态的C2A4和液态A2D2,当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知0.4 mo1 C2A4与一定量液态A2D2发生上述反应,可放出256.6 kJ的热量,则上述反应的热化学方程式为 。?
查看答案和解析>>
科目: 来源: 题型:
A.钢铁腐蚀时可能发生的正极反应2H2O + O2+4e- = 4OH -?
B.FeSO4的溶液中加硫酸酸化的H2O2?
2Fe2+ +H2O2 + 2H+ = 2Fe3+ + 2H2O?
C.用氨水吸收过量的SO2??
NH3·H2O + SO2 = NH4+ + ![]() ?
?
D.少量的氢氧化钙溶液与碳酸氢钠溶液混合 OH- + ![]() = H2O +
= H2O + ![]() ??
??
查看答案和解析>>
科目: 来源: 题型:
①X元素的非金属性比W元素的非金属性强 ②Y元素的氢化物的沸点比与其同族且原子序数小的元素的氢化物的沸点高 ③X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ④Z元素的最高价氧化物对应的水化物的酸性最强,Z元素所在的周期中含有32种元素 ⑤Y、Z的气态氢化物水溶液的酸性Y<Z?
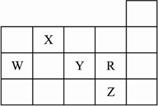
A.①③⑤ B.①②③? C.②③④⑤ D.①②③⑤?
查看答案和解析>>
科目: 来源: 题型:阅读理解
名称 | 化学式 | 颜色、状态 | 溶解度(g) | 熔点(℃) | 密度(g/cm3) |
乙二酸 | H | — | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H | 无色晶体 | — | 101.5 | 1.650 |
注:乙二酸(HOOC—COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象是________________。
(2)向盛有5 mL乙二酸饱和溶液的试管里滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为____________,说明乙二酸有_____________性。
(3)已知草酸分解的化学方程式为:H![]() H2O+CO2↑+CO↑,用如图装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因_____________(从下列序号中选择)。
H2O+CO2↑+CO↑,用如图装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因_____________(从下列序号中选择)。
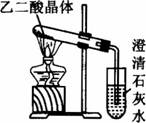
a.草酸晶体的熔点低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察
b.因为加热的是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否还有其他分解产物
C.在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰
(4)设装置也不符合绿色化学的要求,试说明原因____________________________。
(5)实验室用酸碱滴定法测定草酸晶体分子中结晶水个数的方法如下:称取a g草酸晶体溶于水配成200 mL溶液,取20 mL该溶液用0.1 mol·L-1NaOH溶液滴定,当达到终点时,用去NaOH溶液b mL,则每个草酸晶体分子中结晶水个数x=__________(用字母表示算式)。
查看答案和解析>>
科目: 来源: 题型:
A.电解时,阳极反应是:I--6e-+3H2O=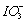 +6H+?
+6H+?
B.电解一段时间后,电解质溶液的pH几乎不变?
C.电解时,石墨作阴极,不锈钢作阳极?
D.电解过程中,当生成3 mo1 H2时,转移6 mole-?
查看答案和解析>>
科目: 来源: 题型:
A.在水电离出的c(H+)=10-13mol·L-1的溶液中K +、![]() 、Br-、Ba2+能够大量共存?
、Br-、Ba2+能够大量共存?
B.在稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ·mol-1,若将含0.5 mo1 H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ?
C.由C(石墨)=C(金刚石);ΔH=+119 kJ·mol-1可知,金刚石比石墨稳定?
D. 2008年奥运会提出“绿色奥运、科技奥运、人文奥运”的理念。绿色奥运是指奥运场馆建设均使用天然材料,不使用合成材料?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com