
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.当A、B都是金属,A的还原性一定比B强
B.当A、B都是非金属,A的非金属性一定比B强
C.当A是金属时,B可能是金属,也可能是非金属
D.当A是非金属时,B可能是非金属,也可能是金属
查看答案和解析>>
科目: 来源: 题型:
①NaHCO3热稳定性差 ②增加甜味 ③产生CO2 ④提供钠离子
A.②③ B.①③ C.①④ D.②④
查看答案和解析>>
科目: 来源: 题型:
A.Na B.Mg C.Al D.Fe
查看答案和解析>>
科目: 来源: 题型:
A.碱金属单质中锂的密度最小,熔点最低 B.碳酸钾溶液的pH<7
C.乙醇与金属钾反应生成氢气 D.用电解铯盐溶液的方法冶炼金属铯
查看答案和解析>>
科目: 来源: 题型:
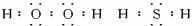
(1)写出氧族元素中含有18e-的两种氢化物的电子式___________________________。
(2)请你归纳:非金属元素氢化物的稳定性与氢化物的反应热ΔH的关系__________________。
(3)写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
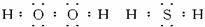
(1)乙元素在元素周期表中的位置_________,H的电子式_________。
(2)写出反应①的离子方程式:__________________。
(3)将甲元素单质和石墨用导线相连,放在E溶液中,构成了原电池,写出该原电池的负极电极反应式:____________________________________。
(4)反应②中
查看答案和解析>>
科目: 来源: 题型:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是__________________________________________,
不能用铜丝搅拌棒代替环形玻璃棒的理由是________________________________________。
(2)经数据处理,t2-t1=
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1____ΔH(填“<”“>”或“=”),理由是____________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.A中吸热92.4 kJ B.A中热量变化值大于B中的2倍
C.B中放热46.2 kJ D.A中热量变化值等于B中的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com