
科目: 来源: 题型:
A.由于水中存在氢键,所以水很稳定
B.能与酸反应生成盐和水的氧化物一定是碱性氧化物
C.Na2O2中既含有离子键,又含有非极性键
D.由于C=O键是极性键,所以CO2是极性分子
查看答案和解析>>
科目: 来源: 题型:
A.氯化钠和氯化铯 B.碘和干冰
C.金刚石和晶体硅 D.二氧化硫和二氧化硅
查看答案和解析>>
科目: 来源: 题型:
A.含有非极性键的化合物其分子一定是非极性分子
B.原子晶体中只存在非极性共价键
C.冰是水分子通过氢键作用而形成的分子晶体
D.若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
查看答案和解析>>
科目: 来源: 题型:
A.由多种非金属元素组成的化合物一定是共价化合物
B.原子晶体的熔点一定比金属晶体高
C.晶体熔化时化学键一定发生断裂
D.离子反应中,阴离子与阳离子结合时不一定生成离子化合物
查看答案和解析>>
科目: 来源: 题型:
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高 D.稀有气体的原子能形成分子晶体
查看答案和解析>>
科目: 来源: 题型:
A.分子晶体的状态变化,只需克服分子间作用力
B.离子晶体中一定含有金属阳离子
C.金属晶体容易导电,是因为其中含有自由电子
D.原子晶体中只存在非极性共价键
查看答案和解析>>
科目: 来源: 题型:
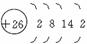
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图______________。
(2)以上元素形成的金属单质中,熔点最低的是_________(填元素符号)。
(3)NH3·H2O的电离方程式为NH3·H2O![]()
![]() +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是_________(填序号)。
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是_________(填序号)。

(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写元素符号)。
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破。如XeO3在一定条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:
_____________________________________________。
(6)请在上表中铷和砷的相应位置标出它们的元素符号。
查看答案和解析>>
科目: 来源: 题型:

又知①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中一种常见的金属。
②常温下X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
试完成下列问题:
(1)丁在甲和X同时存在的条件下,可发生电化学腐蚀,写出正极的电极反应式:____________________________________________。
(2)将少量W的饱和溶液滴入热的X中,反应方程式为_________________________________。
(3)若Z、W溶液的pH均为5,则两溶液中由水电离出H+的物质的量浓度之比为_________。
(4)已知
查看答案和解析>>
科目: 来源: 题型:
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请完成以下问题:
(1)A分子的空间构型是_________;B分子的电子式为_________;含Y元素的氧化物还有_________。
(2)写出②中涉及反应的化学方程式:____________________________________。
(3)由B反应生成1 mol A放出的热量为46.2 kJ,写出该反应的热化学方程式:______________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式___________________________________,被氧化的A占参加反应A的百分比为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com