
科目: 来源: 题型:
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后紫红色褪去,表明![]() 为紫红色
为紫红色
查看答案和解析>>
科目: 来源: 题型:
①pH=a的酸A与pH=b的NaOH溶液等体积混合,混合后测得溶液的pH=7,且a+b>14
②B与NaCl不反应,能与Na2CO3反应生成CO2
③向浓度为10-3mol·L-1的C溶液中滴加甲基橙试液时,溶液变成黄色
④酸D的钠盐不止一种,向两种D的钠盐水溶液中分别滴加紫色石蕊试液时,一个显红色,一个显蓝色
从上述实验数据和现象中,可以用来确定是弱酸的实验是( )
A.①③④ B.②③ C.②③④ D.全部
查看答案和解析>>
科目: 来源: 题型:
A.分别通Cl2、SO2于装有品红溶液的两支试管中,就可区别Cl2和SO2
B.分别向装有甲苯和溴苯的两支试管中加水以区别甲苯和溴苯
C.向试管内的溶液中加入NaOH溶液,在试管中用红色石蕊试纸检验溶液中有无![]()
D.某溶液中通入Cl2后,滴入KSCN溶液以检验原溶液中有无Fe2+
查看答案和解析>>
科目: 来源: 题型:
A.蛋壳能否溶于酸 B.白酒中是否含甲醇
C.检验自来水中是否含氯离子 D.鉴别食盐和小苏打
查看答案和解析>>
科目: 来源: 题型:

(1)用_________(填仪器名称)量取10.00 mL食用白醋,在___________(填仪器名称)中用水稀释后转移到100 mL的__________ (填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00 mL上述溶液倒入烧杯中,连接好DIS系统,向烧杯中滴加浓度为0.100 0 mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见上图)。
①用滴定管盛氨水前,滴定管要用____________________________________润洗2—3遍,润洗的目的是_____________________________________________。
②氨水与醋酸反应的离子方程式是____________________________________。
③食用白醋中醋酸的物质的量浓度是______________________。
查看答案和解析>>
科目: 来源: 题型:

实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol·L-1 NaOH溶液的烧杯中。试完成下列问题:
(1)合金表面最先产生气泡的位置是___________ (填“切口断面”或“非切口断面”),反应的离子方程式为:__________________________________。
(2)合金表面会形成原电池,其负极的电极反应式为:__________________________________。
(3)不同时间电子天平的读数如下表所示:
实验操作过程 | 时间/min | 电子天平的读数/g |
烧杯+NaOH溶液 |
| 80.0 |
烧杯+溶液+样品 | 0 | 87.8 |
1 | 87.5 | |
2 | 87.3 | |
3 | 87.2 | |
4 | 87.2 |
则合金中铁的质量分数为____________(保留三位有效数字,下同)。
(4)上述50 mL NaOH溶液中最多可加入的铁铝合金样品质量为___________。
查看答案和解析>>
科目: 来源: 题型:
请完成相关问题:
(1)步骤①需要的实验仪器是:__________________________________________________。
(2)步骤_______(填编号)需要使用干燥器,使用干燥器的目的是______________________。
(3)步骤③具体的操作是:将盛有硫酸铜晶体的坩埚放在三脚架上面的泥三角上,用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体。加热一段时间后,若晶体显蓝色,此时应当___________________________________________________;若晶体变为黑色,此时应当_______________________________________________。
(4)步骤⑥的目的是_______________________________________________________。
(5)若操作正确而实验测得的硫酸铜晶体里结晶水的含量偏低,其原因可能有___________。(填编号)
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
查看答案和解析>>
科目: 来源: 题型:
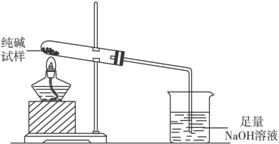
主要实验步骤如下:
①用天平准确称量出干燥大试管的质量为14.2 g,然后称取2.0 g已研碎的纯碱样品并放入干燥的试管中。
②用酒精灯慢慢加热,先从试管底部加热,然后将加热部位逐步前移,至烧杯中的导管口有气泡产生时,仍继续前移加热,使冷凝在试管壁上的水全部变成气体逸出。
③待试管冷却后,在天平上称出试管和碳酸钠的质量。
④加热,再称量,至两次称量误差不超过0.1 g为止,此时试管和碳酸钠的质量为15.9 g。
请填空和完成问题:
(1)停止加热前,要先把导管从烧杯中取出。目的是__________________________________。
(2)该试样中纯碱的质量分数的计算式为w(纯碱)=____________________________________。
(3)甲同学通过称量反应前后烧杯(含烧杯中的溶液)质量变化求算试样中纯碱的质量分数。甲同学求得的结果稍大于(2)所得的结果。原因是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:

请完成相关问题:
(1)A瓶所盛试剂的作用是_______________________;
B瓶所盛的试剂是______________________________;
C瓶所盛试剂的作用是__________________________。
(2)A瓶要用冷水冷却的原因是___________________。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则___________。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是_________________________________________________________。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com