
科目: 来源: 题型:
A.澄清石灰水中滴加稀硝酸:Ca(OH)2+2H+![]() Ca2++2H2O
Ca2++2H2O
B.用Pt电极电解饱和氯化镁溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向FeBr2溶液中通入过量氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++![]() +2OH-
+2OH-![]() CaCO3↓+
CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、![]() 、Na+
、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2-、![]() 、
、![]()
C.在加入铝粉能产生H2的溶液中:![]() 、Fe2+、
、Fe2+、![]() 、Cl-
、Cl-
D.由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Cl-、![]() 、Na+
、Na+
查看答案和解析>>
科目: 来源: 题型:
A.硫铁矿燃烧前要粉碎,因为大块的硫铁矿不能燃烧
B.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便SO3吸收完全
C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
D.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
查看答案和解析>>
科目: 来源: 题型:
A.分散质粒子在1 nm—100 nm之间的分散系称为胶体,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B.光线透过胶体时,胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
C.布朗运动是胶体的性质之一,布朗运动是胶体稳定的次要原因
D.胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证明胶体属于电解质溶液
查看答案和解析>>
科目: 来源: 题型:
(1)配平下列反应化学方程式:
____Cu2S+____![]() +____H+
+____H+![]() _____Cu2+_____+
_____Cu2+_____+![]() +_____Mn2++_____H2O
+_____Mn2++_____H2O
(2)试计算原始混合物中Cu2S的质量分数。
查看答案和解析>>
科目: 来源: 题型:
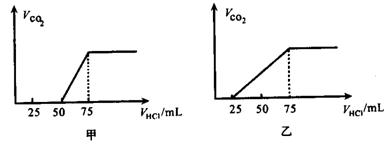
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是_______________,其物质的量之比是_______________,产生的CO2气体体积(标况)是_______________。
乙所得溶液中存在的溶质是_______________,其物质的量之比是_______________,产生的CO2气体体积(标况)是_______________。
查看答案和解析>>
科目: 来源: 题型:
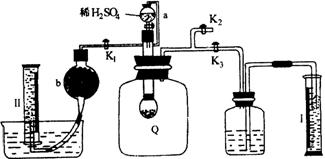
(1)Q内发生化学反应时,生成的气体是__________________________________________。
(2)为了测定反应生成气体的总体积,滴加稀硫酸之前,K1、K2、K3中应当关闭的是_______________,应当打开的是_______________。
(3)当上述反应停止,将K1、K2、K3均处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________。
(4)b中装的固体试剂是___________________________________________,为什么要缓缓打开K1?___________________________________________________________。
(5)实验结束时,量筒Ⅰ中有x mL水,量简Ⅱ中收集到y mL气体(已折算成标准状态),则过氧化钠的纯度的数学表达式是___________________________(化成最简表达式)。
查看答案和解析>>
科目: 来源: 题型:阅读理解
①早在1785年,卡文迪许在测定空气组成时,除去空气中的氧气、氮气等已知气体后,发现最后总是留下一个体积是总体积1/200的小气泡。
②1892年,瑞利在测定氮气密度时,从空气中得到的氮气密度为1.257
③瑞利和拉姆赛共同研究后认为:以上两个实验中的“小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体。经反复实验,他们终于发现了化学性质极不活泼的惰性气体——氩。
请回答下列问题:
(1)空气缓慢依次通过氢氧化钠溶液、浓硫酸、灼热铜粉(过量)、灼热镁粉(过量),最后用排水法收集,则依次除去的气体是___________________、__________________、_______________、_______________。
(2)材料①②的“小误差”对测定空气和氮气密度的实验而言是_______________(填“主要因素”或“次要因素”)。
(3)材料③中科学家抓住了“小误差”而获得重大发现说明___________________________。
查看答案和解析>>
科目: 来源: 题型:
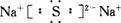
请回答:
(1)用化学式表示;丙为_____________,C为______________,X的电子式为_______________。
(2)写出A与H2O反应的化学反应方程式______________________________。
(3)写出B和G溶液反应的离子方程式:______________________________。
(4)在上图的反应中,不属于氧化还原反应的是(填序号)_______________。
查看答案和解析>>
科目: 来源: 题型:
(1)反应的热化学方程式为_________________________________________________。
(2)又已知:H2O(l)![]() H2O(g);ΔH=44 kJ/mol。则
H2O(g);ΔH=44 kJ/mol。则
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com