
科目: 来源: 题型:
A.若管道漏气遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目: 来源: 题型:
A.白、红、白 B.红、黑、红
C.红、红、红 D.白、黑、白
查看答案和解析>>
科目: 来源: 题型:
![]()
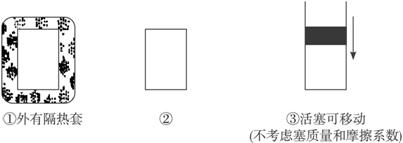
(1)向①中加入3 mol A、1 mol B达到平衡时压强是否一定减小?_______________(填“是”或“否”)。
向②中加入3 mol A、1 mol B或6 mol A、2 mol B达到平衡时______________转化率高(填“前者”或“后者”)。
向③中加入3 mol A、1 mol B或6 mol A、2 mol B达到平衡时C物质的百分含量前者__________后者(填“<”“>”或“=”)。
(2)若维持温度不变,起始时②③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②______________③(填“<”“>”或“=”)。
(3)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为______________(填容器编号)。
查看答案和解析>>
科目: 来源: 题型:
C(s)+O2(g)====CO2(g) ΔH=-393.5 kJ·mol-1 (1)
H2(g)+![]() O2(g)====H2O(g) ΔH=-242.0 kJ·mol-1 (2)
O2(g)====H2O(g) ΔH=-242.0 kJ·mol-1 (2)
CO(g)+12O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1 (3)
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学方程式:___________________。
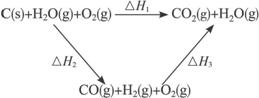
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出如上循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是____________(填“甲”或“乙”);判断的理由是__________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点______________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述______________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
查看答案和解析>>
科目: 来源: 题型:
 ,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
,它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:(1)“亮菌甲素”的分子式为________________________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不能稳定存在。写出其属于醇类的同分异构体的结构简式______________________________。
(3)下列有关“亮菌甲素”的叙述正确的是_______________________(填序号)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与2 mol NaOH反应
(4)核磁共振仪可以测定有机物分子中处于不同化学环境的氢原子及相对数量。氢原子在分子中的化学环境不同,在核磁谱图中就处于不同的位置,化学环境相同的氢原子越多,波谱峰面积越大(或高度越高)。核磁共振氢谱分析发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量的金属钠反应生成1 mol H2。写出二甘醇与乙酸按物质的量之比1∶1反应的化学方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
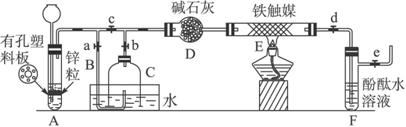
[实验操作]①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸,则A中有氢气生成。打开弹簧夹c、d、e,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内液面下降到保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是_____________________________________________。
(2)C瓶内液面下降到保持不变时,A装置内发生的现象是____________________,防止了实验装置中压强过大;此时再打开弹簧夹b的主要目的是______________________________。
(3)在步骤③反应完成后,如何验证反应后的气体中还含有H2、N2?_________________。
查看答案和解析>>
科目: 来源: 题型:
回答下列问题:

(1)A的化学式为______________________________。
(2)写出反应③的化学反应方程式_________________。
(3)Z和W在催化剂作用下反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_______________。
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为_______________g。
(5)将Z与N反应后的产物溶于水中,则常温该溶液的pH_______________7,其原因是(用离子方程式表示)_______________。
查看答案和解析>>
科目: 来源: 题型:
A.肯定能确定该物质的实验式 B.肯定不能确定该物质的实验式
C.肯定不能确定该物质的分子式 D.有可能确定该物质的结构式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com