
科目: 来源: 题型:
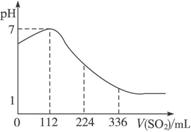
A.SO2 是弱电解质 B.H2SO3不是强酸
C.亚硫酸是比氢硫酸还弱的酸 D.原氢硫酸溶液的物质的量浓度为0.05 mo1·L-1
查看答案和解析>>
科目: 来源: 题型:
A.加入NaOH溶液并微热,生成使湿润的蓝色石蕊试纸变红的气体,可确定有![]() 存在
存在
B.加入Ba(NO3)2溶液生成白色沉淀,加稀盐酸沉淀不消失,可确定有![]() 存在
存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量![]()
查看答案和解析>>
科目: 来源: 题型:
A
B.在标准状况下,
C.
D.0.1 mol ![]() 中所含的电子数约为6.02×1023
中所含的电子数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
A.空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、CO2(非电解质)
B.液氨(电解质)、NH4Cl(铵盐)、HNO3(氧化性酸)、NaOH(强电解质)
C.HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃)
D.NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯)
查看答案和解析>>
科目: 来源: 题型:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。

请回答下列问题:
(1)X元素在周期表中的位置是第__________周期第___________族。
(2)下图是实验室模拟工业法合成C的简易装置。简述检验有C生成的方法_____________。

(3)在298 K时,Y(g)+3Z(g) ![]() 2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
在298 K时,将10 mol Y和30 mol Z充入一密闭容器中,为何放出的热量小于924 kJ?_______________。
(4)C在一定条件下反应生成A的化学方程式是_______________。
(5)X、Y、Z三种元素可组成一种强酸D,C在适当条件下被D吸收生成一种盐E,25 ℃时,0.1 mol·L-1 E溶液中水的电离程度_______________(填“大于”“等于”或“小于”)0.1 mol·L-1 NaOH溶液中水的电离程度。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 E溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_______________。
查看答案和解析>>
科目: 来源: 题型:

请按要求填空:
(1)写出下列反应的反应类型:①_________________反应,⑧_________________反应。
(2)反应③④中某一步反应是与HCl的加成反应,该反应是_________________(填反应序号);设计该步反应的目的是_________________。
(3)物质D的结构简式是_________________。
(4)反应⑨的化学方程式是_________________。
查看答案和解析>>
科目: 来源: 题型:
称此样品6.30 g,加入6.0 mol·L-1的硫酸至过量,产生无色气体560 mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32 g,透过蓝色钴玻璃观察,滤液的焰色反应无紫色。请根据实验填写下列空白:
(1) 若用下图所示仪器组装进行上述实验,气流从左到右各仪器的正确连接顺序为(填编号字母)________接________,________接__________,_________接________,液体X是_________________,汽油的作用是____________。
(2)操作时,怎样才能正确地测出放出气体的体积__________________________________。
(3)若实验中加入硫酸溶液的体积为5.00 mL,则样品中Na2SO3的质量分数是_________,一定含有的杂质是。

查看答案和解析>>
科目: 来源: 题型:
(1)写出符合下列条件的三个方程式。
A.所有的反应物和生成物都由A、B、D三种元素中的一种或两种组成;
B.反应物中有且只有一种单质,三个反应中的单质不同。
_________________;_________________;_________________。
(2)A、B、D三种元素组成的BA4D与D2和KOH可组成燃料电池,该电池正极反应的物质为_________________,负极的电极反应式为_________________。
(3)在D2中完全燃烧
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.a+46b+
C.a+17b+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com