
科目: 来源: 题型:
A.氟利昂(CCl
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.废旧电池的回收,其主要目的是为了保护环境,而不是回收金属
D.淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境
查看答案和解析>>
科目: 来源: 题型:


已知:
![]()
下图是青霉素制取氨苄青霉素的合成路线:
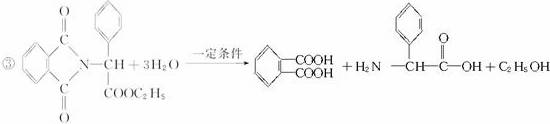
请回答下列问题:
(1)写出反应①④的反应类型:①_____________________,④_____________________。
(2)写出D的结构简式________________________。
(3)写出反应①③的化学方程式:
①_____________________________________________________________,
③______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
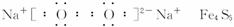
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②—③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7∶5。请填写下列空白:
(1)A的电子式_________________,B的化学式_________________。
(2)反应②的工业生产条件_________________,写出工业生产L时反应①的设备名称____________。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式:__________________________________,
②反应④的化学方程式:__________________________________。
查看答案和解析>>
科目: 来源: 题型:

某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH,见下表,回答下列问题:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________________。
(2)滤渣A的主要成分为_________________。
(3)加入MnS的目的是除去____________________________杂质。
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为_____________________________。
(5)从废旧碱性锌锰干电池中可以回收利用的物质有_________________(写出两种)。
查看答案和解析>>
科目: 来源: 题型:
请回答下列问题:
(1)元素C在周期表中的位置是_______________________。
(2)化合物Y与元素C的最高正价氧化物的水化物恰好完全反应时,其生成物的水溶液呈________________性(填“酸”“碱”或“中”),其原因是(用离子方程式表示)_________________。在所得生成物的水溶液中,存在着如下关系,试用离子浓度符号填写在空白处,完成下列等式:c(H+)+_____________=c(OH-)+____________。
(3)用X、D2、NaOH溶液和惰性电极,可设计出一种燃料电池。则该燃料电池负极的电极反应式为_________________。
(4)元素E的单质的饱和溶液与石灰石反应后所得溶液的漂白性增强的原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
A.HCl和CO B.HCl、H2和CO
C.CH4和NH3 D.HCl、CO和CO2
查看答案和解析>>
科目: 来源: 题型:
A.用碱石灰吸收氨气中的水蒸气
B.金属单质只能与非金属氧化物反应,不能与金属氧化物反应
C.乙醇燃烧生成物总能量低于反应物总能量
D.Cu2S、Na2O2、H2SO4、Fe(OH)3均可通过化合反应生成
查看答案和解析>>
科目: 来源: 题型:
A.含有大量Al3+的溶液:Na+、![]() 、
、![]() 、Cl-
、Cl-
B.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、![]() 、
、![]()
C.含有大量Fe3+的溶液:Na+、Mg2+、![]() 、SCN-
、SCN-
D.含有大量![]() 的溶液:H+、Fe2+、
的溶液:H+、Fe2+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目: 来源: 题型:
A
B
C.体积相同、pH相同的①盐酸 ②硫酸 ③醋酸,被NaOH溶液完全中和,消耗NaOH溶液的体积由小到大的顺序是②<①<③
D.向含有![]() 、CH3COO-、
、CH3COO-、![]() 、
、![]() 离子的溶液中加入足量的Na2O2固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是
离子的溶液中加入足量的Na2O2固体后,假设溶液体积不变,则以上四种离子浓度基本保持不变的是![]() 和CH3COO-
和CH3COO-
查看答案和解析>>
科目: 来源: 题型:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是
A.在上述条件下反应生成1 mol SO3气体放出热量98.5 kJ
B.Q1=2Q2=2Q3=197 kJ
C.若在上述条件下反应生成2 molSO3固体的反应热为ΔH1,则ΔH1<ΔH
D.若在甲容器中使用促进SO3生成的催化剂,则Q=Q1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com